5. Discussion et perspectives
"Structure without function is a corpse,
and function without structure is a ghost"
S. Wainwright
5.1 Rappels des questions posées
A la lumière de notre expérience en oncologie humaine, nous avons essayé de transposer la technique de l’imagerie au FDG par TEDC de la pratique clinique à l’oncologie expérimentale sur petits animaux. Nous avons essayé de lister les différents paramètres physiques (intéressant la caméra et la détection du signal) et les paramètres biologiques (dépendant des animaux). Pour essayer d’optimiser la technique nous avons fait varier tous les paramètres accessibles. Mais il fallait dans un premier temps disposer d’une méthode simple et reproductible de quantification de la fixation tumorale de FDG applicable dans le domaine expérimental sur petits animaux. Nous avons précisé le meilleur compromis entre le délai d’attente, la quantité de traceur à injecter. Nous avons testé des pratiques spécifiques d’acquisition pour permettre de différencier des processus tumoraux de phénomènes inflammatoires. Nous avons étudié l’impact des études scintigraphiques au FDG, dans la connaissance des modèles animaux tumoraux en particulier dans l’étude de la croissance tumorale, de la détection de métastases ou du rejet de la greffe. Et enfin, nous avons voulu préciser l’apport réel de l’imagerie au FDG par TEDC dans le suivi thérapeutique de modèles expérimentaux en oncologie?
C’est l’ensemble de tous ces points particuliers et des différentes questions posées qui va être abordé dans cette discussion.
5.2 La question du choix de l’espèce animale.
Il y a de très nombreux modèles expérimentaux de tumeurs sur la souris, bien documentés et facilement accessibles. La souris a donc représenté la première espèce testée sur le dispositif d’imagerie TEDC. Mais avec un système d’imagerie de résolution limitée à 4,5 mm, la souris présente une limitation majeure de taille et de poids. En effet, les résultats peu concluants des premiers essais avec des souris de 20 grammes, nous ont convaincus de chercher une autre solution. En augmentant le poids et la taille, l’espèce la plus accessible est le rat. Le poids des rats varie en fonction de l’âge de 60 g à 3 semaines à 250-300 g à 6 semaines. Ce qui correspond à un facteur d’augmentation de 3 à 15 par rapport au poids des souris.
En augmentant encore le poids et la taille, on peut étudier d’autres espèces comme le lapin, le chat, le chien ou le cochon. Ces espèces animales ont probablement une taille la plus adaptée pour être étudiées avec un dispositif d’imagerie développé pour l’homme. Mais l’utilisation de ces espèces animales est plus problématique, avec des coûts à l’achat plus élevés, et des conditions d’élevage plus contraignantes. Le principal inconvénient de l’utilisation d’espèces animales de plus grande taille est représenté par l’augmentation prévisible des quantités de radiotraceur et de molécules thérapeutiques. En fonction du poids, ces espèces animales nécessitent plus d’activités de radiotraceurs à injecter et des doses plus importantes d’anesthésiques ou de médicaments à tester. Ce dernier facteur est particulièrement critique lorsqu’on fait des études de thérapie génique qui nécessitent la synthèse et la purification de matériel génétique rare et onéreux. En fin, les équipes locales avec qui nous collaborons étudient principalement des modèles expérimentaux sur le rat. C’est pour l’ensemble de ces différentes raisons, que nous avons choisi le rat comme espèce animale expérimentale.
5.3 Le choix des modèles expérimentaux.
Le choix de l’espèce étant décidé, il restait à choisir les modèles de tumeurs expérimentales à greffer sur les rats. L’étude de modèles expérimentaux s’intégrait dans une collaboration multidisciplinaire avec le service de Biochimie et de Génétique Moléculaire dans une perspective de recherche en oncologie :
- dans l’étude des phénomènes impliqués dans la chimiorésistance
- dans la mise au point de nouvelles stratégies thérapeutiques (comme par exemple: des essais de thérapie génique anti-néoangiogenèse)
- et dans la mise au point de nouvelles techniques de tranfert de gène ou de chimiothérapie par l’intermédiaire de nouveaux vecteurs (liposomes).
Nous avons utilisé deux techniques différentes d’obtention de tumeurs soit par injections de cellules tumorales, soit par greffe tumorale. Pour l’obtention de données homogènes, une seule espèce de rat (Sprague-Dawley) a été utilisée pour l’ensemble de l’expérimentation. Le modèle d’ostéosarcome a été le premier modèle utilisé par notre équipe. Ce modèle tumoral avait été obtenu à partir d’un ostéosarcome de JP Thiéry (Souche Institut Curie, France). Ce modèle est intéressant car il est greffé sur rat non immunodéprimé et présente une évolution spontanée métastatique pulmonaire comparable à l’évolution de la maladie chez l’homme. Le modèle de chondrosarcome était aussi un modèle de greffe tumorale sur rat non immunodéprimé mais caractérisée par son évolution exclusivement locale. Les autres modèles de cancer du sein ou de mélanome ont été développés par l’équipe sur des rats immunodéprimés par injection de Cyclosporine. Le mélanome était obtenu par injections de lignées cellulaires et le cancer du sein soit par injection de cellules tumorales ou par greffe directe de tumeur. Les quatre modèles correspondaient à des modèles tumoraux non chimiosensibles.
Un des objectifs du travail de l’équipe était de développer et d’étudier des modèles expérimentaux pour en avoir une meilleure connaissance en particulier (a) sur le suivi de la greffe tumorale, (b) sur le suivi de l’évolution tumorale et de la survie de l’animal et (c) sur la survenue de métastases. La connaissance des modèles utilisés était un pré-requis à leur utilisation dans des essais thérapeutiques. Pour améliorer la connaissance des modèles animaux il a été réalisé des expérimentations in vitro lorsque les lignées cellulaires étaient disponibles, mais aussi des explorations in vivo en utilisant les techniques isotopiques d‘imagerie avec différents radiotraceurs.
5.4 Le choix du radiotraceur.
Pour améliorer la connaissance des quatre modèles tumoraux expérimentaux, il a été utilisé différents radiotraceurs soit émetteurs de positons (18FDG et 18FNa), soit émetteurs monophotoniques (MIBI et marquages au 99mTc des hématies par le pyrophosphate d’étain).
L’imagerie métabolique au FDG a été la plus employée pour suivre la croissance tumorale et détecter l’apparition de métastases. L’angioscintigraphie a été testée comme facteur indirect de la vascularisation et du volume tumoral pour les ostéosarcomes.
La scintigraphie au 18FNa a été expérimentée (a) pour étudier la fixation tumorale et le caractère ostéogénique des tumeurs primitives d’origine osseuse (ostéosarcome) ou articulaire (chondrosarcome) et (b) pour détecter et étudier le caractère ostéogénique des métastases pulmonaires.
Enfin pour essayer de déterminer in vivo le caractère de chimiorésistance des tumeurs, il a été réalisé des scintigraphies au MIBI.
5.5 La technique TEDC/FDG dans la pathologie tumorale expérimentale.
Dans cette étude, nous avons voulu optimiser et valider la technique d’imagerie clinique au FDG/TEDC appliquée à l’imagerie de modèles expérimentaux de tumeurs greffées sur des rats. L’exploration scintigraphique avec du FDG est incontournable dans un certain nombre d’indications en cancérologie humaine. L’utilisation d’une gamma caméra a permis à de nombreuses équipes d’accéder à la technologie des émetteurs de positons à une période où le sous-équipement chronique en caméra à permis de rendre de nombreux services en oncologie en particulier en modifiant la prise en charge des patients dans 20 à 30% des cas en fonction de pathologie concernées (selon notre expérience personnelle). Si ces caméras TEDC sont progressivement remplacées par des caméras TEP dédiées de dernière génération associées à un module de TDM. Ces caméras dédiées sont les dispositifs les plus performants actuellement. Les caméras TEDC ont été peu utilisée en pathologie oncologique expérimentale en particulier dans l’étude de petits animaux (Lausson 2001). C’est probablement dû à la faible sensibilité et le manque de résolution de la technique TEDC en comparaison des caméras TEP dédiées ou des micro-TEP développées spécifiquement pour les petits animaux.
Les microTEP affichent des performances de résolution de l’ordre de 2 mm (Chatziioannou 1999, Knoess 2003) et les caméras TEP dédiées de l’ordre de 6 à 8 mm (Heiss 1995, Boisgard 2003) et les caméras TEDCde 5 à 8mm (Boehm 1999, Bailey 1994, Kunze 2000). Les caméras TEP dédiées et les microTEP ont une sensibilité de détection supérieure par rapport aux caméras TEDC. La sensibilité de détection estimée par la méthode d’une source linéaire dans l’air est 150 fois plus grande en 3D et de 25 fois en 2D par rapport aux TEDC(Bailey 1994).Lasensibilité de détection et le taux maximum de détections de coïncidences vraies est plus faible dans les caméras TEDC par rapport aux TEP dédiés (Kunze 2000).L’avantage des détecteurs utilisant des cristaux de NaI est la possibilité de disposer de détecteurs de grande taille avec des surfaces de détection de l’ordre de 33 cm sur 45 cm . La grande taille des détecteurs autorise l’exploration d’un rat entier (ou même deux rats disposés côte à côte) sur un seul champ d’exploration alors qu’il est nécessaire d’explorer le corps entier d’un rat avec plusieurs positions de lit sur les microTEP (Berger 2002).
Pour diminuer les inconvénients des caméras TEDC par rapport aux TEP, il est nécessaire d’optimiser la technique pour obtenir les meilleures performances.
Dans un premier temps, nous avons développé et utilisé un lit d’examen à l’usage exclusif de l’exploration animale. Le système permettait de réaliser des acquisitions avec des rayons d’acquisition plus faible (<15cm) correspondant à la distance minimum des détecteurs par rapport au centre de rotation. Ce simple moyen physique permet d’augmenter l’angle physique de détection et donc d’augmenter la sensibilité de taux de comptage sans diminuer la résolution.D’après Knoess et al. (Knoess 2003)., l’angle solide Ω peut être estimé d’après la formule :
Ω = 4πsin (tan–1(A/D))
avec A la taille de détection axiale des détecteurs (33cm)
et D la distance entre les 2 détecteurs (35 cm or 15 cm)
Le calcul théorique est en faveur d’une amélioration de 73% du taux de comptage ce qui est en accord avec des mesures effectuées avec une source ponctuelle de 22Na.
Deuxièmement, nous avons voulu disposer d’une méthode de mesure pour quantifier la fixation tumorale de FDG. La quantification de FDG peut faire appel à plusieurs techniques.
Les techniques les plus utilisées sont l’estimation de SUV ou standardized uptake value (Hamberg 1994, Keyes 2000) et la fixation de FDG estimée par la méthode graphique des pentes de Patlak (Patlak 1983, 1985). Le SUV est un index semi-quantitatif mesurant l’activité de la tumeur lors d’une acquisition statique 45-60 min après l’injection du traceur. Il faut normaliser l’activité injectée en fonction du poids du patient (ou de la masse maigre ou de la surface corporelle).
La formule du SUV est : SUV = C(t) / (activité injectée/poids)
avec C(t) la concentration tissulaire mesurée au temps t.
Plus exigeante et plus complexe à utiliser en routine que le SUV, la mesure des pentes d’après la méthode de Patlak nécessite des acquisitions dynamiques pour obtenir une courbe de variation de l’activité tumorale en fonction du temps. Mais il faut disposer aussi, de la fonction d’entrée artérielle obtenue par de multiples prélèvements sanguins.
Ces deux méthodes de référence sont très dépendantes du poids des animaux. Cela a été décrit en particulier pour les cochons nains (Boisgard 2003) et probablement aussi pour les rats dont les poids peuvent varier de 100g à 300g en l’espace de quelques semaines. Compte tenu de la variation rapide de poids chez les petits animaux, ces méthodes de référence sont mal adaptées au suivi des petits animaux. De plus, sur les caméras TEDC, ces méthodes de quantification ne sont pas utilisables en l’absence de méthodes de correction d’atténuation par source externe et en l’absence de calibration de la machine. Néanmoins, la grande taille des cristaux de NaI permet d’explorer la totalité du corps entier d’un rat dans le champ de vue. Il est donc possible de faire une estimation de la captation tumorale de FDG par rapport à la fixation totale du rat. A partir des données de l’acquisition tomographique, il suffit d’utiliser une coupe épaisse coronale ou la somme de plusieurs coupes fines coronales incluant la totalité du rat. On dessine une région d’intérêt (ROI) sur la tumeur et l’activité détectée dans la région est comparée à l’activité totale détectée dans le corps entier de l’animal. Cette méthode peut être appliquée (i) à des acquisitions tomographiques simples (ii) sur plusieurs acquisitions tomographiques à des temps différents et (iii) sur des acquisitions tomographiques dynamiques. Bien entendu, la limitation de résolution de la machine par des effets de volume partiel est responsable d’erreur dans l’estimation de la fixation tissulaire de FDG en particulier pour des structures de petite taille proche ou inférieure à la limite de résolution de la machine.
Cette estimation a été utilisée principalement pour suivre la fixation tumorale chez les mêmes animaux et non pour calculer la fixation tumorale absolue de FDG. Malgré les limites physiques de détection de notre caméra TEDC, nous avons trouvé que cette technique était un moyen simple, fiable et reproductible de la quantification tumorale de la captation de FDG dans les modèles expérimentaux de tumeurs greffées.
Troisièmement, pour optimiser l’acquisition de FDG par la machine TEDC, nous avons voulu déterminer le délai optimal entre l’injection du radiotraceur et l’acquisition. Pour minimiser les problèmes de faibles taux de comptage des acquisitions tardives, nous avons utilisé des activités de radiotraceur plus élevées. Nous avons tenu compte du fait que l’irradiation supplémentaire des animaux était éthiquement justifiable. L’augmentation de l’activité injectée (x2 ou x3) permettait de compenser la diminution du taux de comptage dûe à la décroissance du 18F sur des acquisitions tardives de 2h à 5h après l’injection. L’augmentation de l’activité se traduisait par une augmentation du volume à injecter, mais aucun effet secondaire n’a été enregistré suite à l’augmentation du volume d’injection. Le volume injecté dépendant de l’activité spécifique du radiotraceur et même dans des conditions peu favorables d’éloignement de 300 à 400 km du site producteur de FDG, nous n’avons jamais injecté des volumes de plus de 1mL de FDG. L’augmentation de l’activité du FDG injectée n’a pas été responsable de modification de la croissance tumorale. Dans notre expérience, il n’a pas été constaté de différence de progression tumorale ou de survie des animaux témoins ou traités suivis par de multiples scintigraphies au FDG. De plus, à notre connaissance, il n’a pas été publié dans la littérature, de résultats in vitro ou in vivo, de l’ effet (cytotoxique ou cytostatique) du FDG sur les lignées cellulaires tumorales.
Nous avons trouvé que la quantification de la fixation tumorale de FDG estimée par notre méthode était plus fiable et plus reproductible avec un meilleur rapport signal/bruit sur les acquisitions réalisées tardivement (5h). Dans notre étude, nous avons montré une augmentation significative du rapport de fixation suer les images tardives par rapport aux acquisitions précoces (a) sur des acquisitions dynamiques de 1h à 5h sur un groupe de 4 rats avec un ostéosarcome mais aussi, (b) sur un groupe de 15 rats avec un mélanome exploré à 1h et 5h après l’injection de FDG. Ces résultats in vivo ont été confirmés in vitro par les études de captation du FDG par différentes lignés tumorales (8 lignées différentes) et non tumorales (macrophages). Des résultats concordants ont été décrits dans la littérature mais avec des temps d’incubation de FDG plus courts. Zhuang et al ont mesuré à 20 min et 60 min un taux de captation cellulaire croissant avec le temps pour les lignées tumorales et non pour les macrophages de donneurs sains (Zhuang 2001).
L’augmentation de la captation cellulaire dans le temps par les lignées cellulaires tumorales peut avoir un impact sur l’imagerie in vivo en améliorant les performances de détection en augmentant le rapport signal/bruit des machines TEDC mais aussi des TEP dédiés. C ‘est un des résultats intéressants de la comparaison de l’imagerie TEP et TEDC avec la détection d’une métastase pulmonaire visible sur l’acquisition TEP tardive et non sur l’acquisition TEP précoce.
L’augmentation de la captation cellulaire peut servir aussi à aider à différencier l’origine d’une lésion. In vitro l’évolution de la captation cellulaire du FDG avec le temps d’incubation est différente entre les cellules tumorales et les cellules normales (Yamada 1995).
Cette augmentation de captation est significativement plus élevée, pour les huit lignées cellulaires tumorales, que pour les leucocytes de donneurs volontaires. In vivo, nous avons démontré que la captation de FDG d’une lésion inflammatoire provoquée par injection de thérébentine sur une cuisse était différente de la captation tumorale de l’ostéosarcome gréffé sur la cuisse controlatérale (p = 0.04). Cette observation pourrait aider à préciser l’origine une formation inconnue en permettant de différencier l’origine tumorale de l’origine inflammatoire en réalisant des scintihgraphies au FDG en deux temps. Cette différence de fixation précoce et tardive, entre une origine tumorale et inflammatoire avait déjà été décrite par Zhuang et coll. (Zhuang 2001) mais, avec une technique comparant la captation à 45 min et à 90 min et non à 1 h et 5h comme dans notre travail. Cette observation peut avoir un intérêt potentiel chez l’homme en permettant d’utiliser cette différence de comportement de captation cellulaire pour améliorer les performances de l’imagerie au FDG. En clinique humaine, la comparaison de résultats acquis précocement et tardivement a permis de préciser la nature d’une masse tumorale thoracique (Zhuang 2001, Gupta 1998) et différencier le grade des tumeurs des tissus mous (Lodge 1999).
Quatrièmement, en utilisant les améliorations décrites nous avons voulu valider la technique FDG/TEDC, pour surveiller la croissance tumorale et l’aspect métabolique de différents modèles de tumeurs greffées sur le rat. Sur les 3 différents modèles de greffe tumorale, nous avons trouvé une corrélation entre la croissance volumique et l’augmentation du métabolisme estimé par FDG/TEDC. La détectabilité de la tumeur en TEDC dépend de sa taille mais aussi de la concentration radioactive tumorale. Une grosse tumeur faiblement radioactive peut ne pas être détectée, alors qu’un petite tumeur (dont la taille est inférieure à la limité de la résolution de la machine) peut être détectée si elle est très hypermétabolique. Par exemple, un mastocytome P815 de 3mm de diamètre sur une souris DBA/2 a été détecté sur une machine TEDC (Lausson 2001). Nous avons montré que la technique est suffisamment sensible, pour détecter des métastases pulmonaires d’ostéosarcome de diamètre supérieur à 5 mm.
Pour le suivi in vivo de modèles tumoraux expérimentaux, la technique FDG/TEDC est capable de définir la progression ou la régression de la maladie après traitement à condition d’effectuer des acquisitions tardives. En effet il a été démontré que les tumeurs ont une cinétique de captation variable avant et après l’administration de traitements (Hamberg 1994). Pour des patients porteurs de tumeurs pulmonaires, la fixation tumorale estimée par des acquisitions TEP dynamiques atteint un plateau en moyenne à 300 min avant traitement et après traitement, ce plateau est atteint plus précocement à 150 min. Pour faire du suivi thérapeutique, il est donc recommandé de réaliser les acquisitions dans les conditions de captation les moins variables correspondant au moment d’obtention du plateau. Le délai d’obtention du plateau semble très variable d’après Hamberg pour les cancers pulmonaires chez l’homme. La captation estimée avant le plateau conduit à une erreur estimée à 42% ± 17% à comparer à l’erreur estimée de 8% ± 7% pour les mesures tardives à 5 h après l’ injection (Hamberg 1994). Pour le suivi thérapeutique des modèles animaux nous avons tenu compte de ce résultat important et décidé de réaliser les acquisitions tardives pour limiter les erreurs de mesure de fixation tumorale.
Cinquièmement, le suivi volumique de la cible tumorale est la méthode de référence pour mesurer l’efficacité thérapeutique d’un traitement antitumoral en clinique humaine mais aussi dans les modèles expérimentaux. Mais l’imagerie morphologique est moins sensible que l’imagerie fonctionnelle qui est capable de détecter précocement des modifications métaboliques qui précèdent les changements morphologiques. En accord avec les données publiées sur le suivi thérapeutique avec l’imagerie FDG (Romer 1998, Ryu 2002) notre expérimentation sur l’ostéosarcome greffé et traité par une stratégie de thérapie moléculaire a montré que la fixation de FDG est le facteur le plus corrélé (inversement) à la survie dans les deux groupes traité et non traité. L’impact de l’imagerie fonctionnelle métabolique peut être expliqué, par le fait que la taille de la tumeur dépend des cellules viables mais aussi des cellules non viables qui peuvent être en situation d’apoptose ou de nécrose (Kubota 1992). Le FDG s’accumule dans des zones de tumeur viable mais pas dans les régions partiellement ou totalement nécrosées, et la fixation tumorale de FDG peut être inversement proportionnelle à la masse tumorale (Chung 1999).
De plus, la technique d’imagerie par FDG/TEDC a été capable de montrer des variations métaboliques de façon plus précoce que les modifications morphologique estimées par les méthodes conventionnelles. Le rejet de greffe tumorale de mélanome après l’arrêt de l’immunosuppression a été détecté 4 jours après l’arrêt de l’immunosuppression. Dans le même temps, le volume tumoral continuait d’augmenter pendant 4 jours supplémentaires avant de commencer de diminuer. De plus, 18 jours après l’arrêt du traitement immunosuppresseur, une masse était toujours palpable (autour de 5 cm3) alors qu’elle ne captait pas le FDG de façon significative. L’analyse histologique de ces masses à confirmé le rejet de greffe et l’absence de cellules tumorales résiduelles. Cette capacité de détection précoce des anomalies métaboliques pourrait être utile pour interpréter les effets précoces et transitoires de nouvelles stratégie thérapeutiques testées sur des modèles expérimentaux animaux.
Il existe d’autres techniques de suivi des modèles animaux en particulier les méthodes d’imagerie morphologique conventionnelles, éventuellement modifiées, pour être utilisables pour l’exploration de petits animaux. L’imagerie morphologique en coupes (TDM, IRM ou échographie) peut être utilisée intérêt se rapprocher des pratiques cliniques en oncologie. Certains domaines comme les modèles de tumeurs cérébrales gliales sont d’ailleurs mieux explorées par IRM que par l’imagerie isotopique. Dans tous les domaines où la résolution et la localisation anatomique sont privilégiées, il faut faire appel aux techniques d’imagerie morphologique. Les critères d’interprétation classiques même en imagerie animale restent toujours des critères anatomiques et volumiques.
Voici un exemple de 3 tumeurs (T1, T2 et T3) dont l’évolution est jugée par des méthodes morphologiques qui font appel à des mesures de diamètre. Sachant que les explorations sont réalisées avec la même fréquence pour les trois tumeurs (tous les mois), comment classer les tumeurs en fonction du temps de doublement, estimé visuellement ?
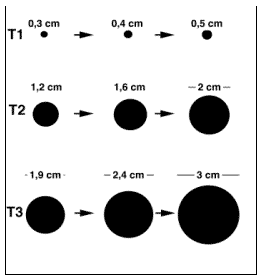
(Erasmus 2000)
En fait, les trois tumeurs ont le même temps de doublement qui est estimé à un mois.
En oncologie expérimentale tout comme en oncologie clinique, les explorations morphologiques et les explorations fonctionnelles sont complémentaires. C’est pour cette raison qu’après avoir développé et commercialisé des systèmes hybrides pour la clinique humaine, les sociétés développent des systèmes d’imagerie hybride pour animaux : SPECT/TDM de TEP/TDM …
5.6 La technique TEDC/FDG pour l’exploration humaine
Il est difficile de conclure ce travail sans faire un bilan du retentissement de l’expérimentation animale en retour sur l’exploration clinique humaine avec la même caméra TEDC. Les résultats de l’exploration animale ont montré un impact sur le suivi des modèles animaux bien supérieur à ce que les performances théoriques ou sur des études sur fantôme, ne le laissait supposer (tout comme dans la prise en charge des patients en oncologie). Ces résultats nous ont sensibilisé sur la capacité du dispositif TEDC à fonctionner en mode 2D avec des activités de FDG plus élevées que celles attendues pour un détecteur composé d’un cristal NaI de grande taille. L’optimisation de la technique, nous a montré que le temps d’attente était un facteur majeur de l’amélioration de la détectabilité des lésions évolutives hypermétaboliques. En situation d’exploration de routine, les temps de captation de FDG sont maintenant allongés à 90 minutes avant l’acquisition. L’augmentation du temps de captation du FDG impose un temps d’attente plus long pour les patients. Les conditions d’attente doivent donc, être optimisées : (a) avec un confort accru favorisant la décontraction des patients (télévision…) et (b) un contrôle plus rigoureux de la température des salles d’attente (avec utilisation d’un chauffage d’appoint si nécessaire) pour limiter les fixations de FDG par la graisse brune. Ces phénomènes avaient été constatés fréquemment l’hiver, lors d’exploration au FDG d’animaux laissés dans des pièces insuffisamment chauffées.
5.7 La technique TEDC optimisée
La TEDC permet d’accéder à l’imagerie fonctionnelle avec des émetteurs de positons. Son utilisation est possible pour l’imagerie de petits animaux comme le rat. La fiabilité de la méthode est bonne, mais il faut garder à l’esprit les limites de la méthode en particulier dans le domaine de la sensibilité de détection et surtout de la résolution. Une des limitations de l’utilisation des machines cliniques pour l’expérimentation animale est la disponibilité de la machine, avec des horaires parfois incompatible avec l’utilisation d’isotope à demi-vie courte. Le principal inconvénient de l’utilisation de machine clinique en expérimentation animale est un problème d’hygiène et de risque d’infectieux. La multiplication des explorations animales et la disponibilités de nouveaux traceurs émetteurs de positon devrait conduire à l’utilisation de machines TEP animales qui règle le problème de disponibilité et le risque infectieux en permettant des explorations de meilleure qualité mais au prix d’un investissement important. Compte tenu des sommes que représente l’achat d’une machine dédiée il faudra se poser la question des autres moyens d’imageries. Il existe des moyens de détection adaptés à l’imagerie animale pour des radiotraceurs émetteurs monophotoniques soit avec des caméras conventionnelles équipées de collimateurs sténopés soit avec des caméras dédiées pour le petit animal (permettant des études statiques, dynamiques ou tomographiques). L’imagerie morphologique ne doit pas être oubliée en particulier avec les techniques d’ échographie, de doppler, de TDM et d’IRM qui sont aussi adaptées et développées pour l’exploration de petits animaux. L’imagerie morphologique reste complémentaire de l’imagerie fonctionnelle. Pour de nouvelles thérapeutiques (anti-angiogenèse, thérapie génique….) qui provoquent plutôt des modifications de type cytostatiques et non cytotoxiques, l’imagerie morphologique (pourtant très résolutive), ne permet pas un suivi aussi sensible que l’imagerie fonctionnelle utilisant des traceurs émetteurs de positons.C’est l’exemple du rejet de greffe visualisé plus précocement en imagerie métabolique au FDG que par la mesure du volume tumoral.
5.8 Perspectives
Le résultat de ce travail doit être analysé comme le résultat d’une étude pilote de transfert des techniques d’imagerie fonctionnelle (radiotraceurs et caméras) utilisée en exploration humaine vers l’exploration animale. L’utilisation des modèles de tumeurs expérimentales par les équipes locales est fonction de l’évolution et des demandes spécifiques des différentes équipes qui travaillent en oncologie expérimentale. Un axe intéressant de développement concerne l’étude du modèle de l’ostéosarcome. Ce modèle animal est proche du modèle humain. L’apparition de métastases pulmonaires est la première localisation métastatique (80%) décrite chez l’homme et la deuxième localisation étant l’atteinte d’un deuxième foyer osseux (10 à 20%) alors que l’envahissement ganglionnaire est très rarement décrit (Brenner 2003).
Nous avons montré qu’un mois après la greffe, l’apparition de métastases pulmonaires était de règle en l’absence de traitement général. Nous avons montré que la tumeur primitive et les métastases pulmonaires pouvaient fixer le 18FNa. Sur un petit nombre d’animaux nous avons constaté que le FDG était plus intéressant que le FNa pour détecter les métastases pulmonaires mais nous n’avons pas étudié l’apparition de métastases osseuses. De plus nous n’avons pas comparé l’évolution de la fixation du 18F Na et du 18FDG en parallèle sur des groupes témoins et sur des groupes traités. Ces différents points pourraient faire l’objet de travaux complémentaires (éventuellement) programmés sur une machine dédiée. L’acquisition d’une machine TEP dédiée animale est aussi fonction de la disponibilité d’autres traceurs TEP. Les modèles expérimentaux étudiés dans ce travail continueront à être utilisés et étudiés pour le développement de nouvelles stratégies thérapeutiques (antiangiogenès, liposomes contenant des molécules de chimiothérapie ...) en collaboration avec les équipes de recherche. L’utilisation d’autres radiotraceurs dépendra de leurs disponibilités, tout en sachant que les traceurs à base de 11C ne peuvent pas être utilisés en dehors d’un environnement proche d’un cyclotron. Les marqueurs de l’hypoxie à partir des dérivés imidazolés marqués au 18F pourrait être très intéressant en particulier dans l’étude du modèle de l’ostéosarcome greffé sur le rat.
Les traceurs monophotoniques ne doivent pas être sous-estimés en particulier avec l’utilisation potentielle (a) du MIBI pour l’étude de la chimiorésistance et (b) des marqueurs de l’apoptose (99mTc Annexine V). Les explorations in vivo pourrait être conduites, parallèlement à des études fondamentales de chimiorésistance avec l’expression cellulaire de la PGP et MRP (protéines exprimés dans chimiorésistance) qui peuvent impliquer des gènes MDR (multidrug resistance).
A Limoges, l’avenir proche de l’exploration fonctionnelle en clinique humaine passe par la mise à disposition d’une machine Morpho-TEP correspondant à un TEP dédiée, associé à un module TDM, qui devrait être installé début 2005. Cette machine devrait permettre parallèlement à son activité de routine clinique, de permettre de poursuivre les projets de recherche clinique débutés avec la caméra TEDC, qui s’intéressent au suivi des cancers du poumon opérés, à l’exploration au FDG dans les cancers du col de l’utérus et au suivi des cancer colo-rectaux par l’imagerie TEP.