4. Optimisation pour l’exploration animale
« Tous les êtres circulent les uns dans les autres. Tout est un flux perpétuel. Tout animal est plus ou moins homme; tout minéral est plus ou moins plante, toute plante est plus ou moins animal. Il n’y a qu’un seul individu, c’est le tout. Naître, vivre et passer, c’est changer de forme »
Diderot
Les protocoles d’acquisition en TEP doivent être adaptés aux indications cliniques, qui demandent principalement des renseignements de deux types :
Ce deux types d’applications imposent des stratégies d’optimisation différentes car il n’est pas évident qu’un protocole optimisé sur le plan de la détection soit le plus performant sur le plan de la quantification.
Pour optimiser l’acquisition des animaux en TEDC, il faut étudier les différents paramètres qui influencent les performances de détection de notre machine. On peut modifier plusieurs paramètres concernant :
- la spectrométrie de l’acquisition
- le zoom et la matrice d’acquisition
- La durée de l’acquisition
- La correction d’atténuation (non disponible)
- L’algorithme de reconstruction
- L’activité à injecter à l’animal
- La cinétique du radiotraceur dans les tissus sains et anormaux.
4.1 Optimisation des paramètres physiques de la TEDC
4.1.1 Lit d’acquisition
Une des premières adaptations de la machine TEDC pour réaliser des acquisitions de petits animaux a été de disposer d’un lit dédié. La première motivation était du niveau de l’hygiène. Pour une machine utilisée principalement en routine clinique, le respect des règles d’hygiène a toujours été une préoccupation du prioritaire et pour cela :
- Les explorations animales étaient toujours programmées en fin de vacation clinique, ce qui permettait de réaliser des procédures de décontamination par des décontaminants surfaciques.
- Le sol et les surfaces susceptibles d’être en contact avec des sources de contamination (provenant des animaux, du matériel de contention, du matériel d’anesthésie ou des cages) étaient systématiquement protégés par la mise en place de draps en papier non tissé d’usage unique.
- Pour éviter d’installer les animaux sur le lit d’examen dédié à la clinique, il nous fallait trouver un système de remplacement adapté à l’acquisition de petits animaux. La solution la plus simple qui a été retenue a été l’utilisation d’une gouttière en PVC d’une longueur de 2m :
- Elle permettait d’avoir un double appui sur la partie mobile du lit d’examen et sur le dispositif limiteur de flèche localisé au centre de l’anneau.
- Ce système simple, peu coûteux et amovible permettait de réaliser des acquisitions avec des animaux sans modification de la structure de la caméra.
- Le lit réservé à l’usage exclusif de l’imagerie des animaux permettait de répondre de façon plus satisfaisante au respect des règles d’hygiène.
- Les dimensions et la forme de ce dispositif permettent des acquisitions avec un éloignement variable des têtes permettant même un rapprochement maximum, correspondant à un rayon d’acquisition de 10 cm ce qui est impossible avec le lit d’examen clinique dont la largeur est de 40 cm.
4.1.2 Rayon
Objectif : optimiser les paramètres d’acquisition et évaluer l’importance de l’éloignement des têtes par rapport au centre de rotation. Il a été réalisé des acquisitions sur des rats greffés avec un ostéosarcome en faisant varier le rayon d’acquisition de 10 cm et de 35 cm.
4.1.2.1 Méthode :
Une greffe d’ostéosarcome a été réalisée sur la cuisse droite de 2 rats 4 semaines auparavant.
Les rats avaient un poids compris entre ( 250-300g) au moment de l’examen.
Une activité de 18,5MBq (500 µCi) de FDG était injectée dans une veine de la queue
Sous anesthésie générale (Isoflurane à 4 % et O2à 4L/mn) et 5 heures après l’injection, les rats étaient placés sous la caméra pour 2 acquisitions avec des rayons d’acquisition de 10 et de 35cm.
Paramètres d’acquisition :
- Spectrométrie : fenêtre de 30 % centrée sur le pic photoélectrique 511 keV
- Fenêtre de Coïncidence : Pic Photoélectrique /Pic Photoélectrique
- 30 projections de 45 secondes corrigées de la décroissance
- Zoom de 2
- Matrice de 128x128
- Rayon de 35 cm pour la première acquisition
- Puis, deuxième acquisition avec un rayon de 10 cm et avec les mêmes conditions d’acquisition que la première sauf que le temps d’acquisition des 30 projections débutait à 55 secondes correspondant à la durée de la dernière projection de l’acquisition précédente. Les temps d’acquisition ne différait que pour compenser la décroissance radioactive du traceur.
4.1.2.2 Résultats:
La variation de l’éloignement des détecteurs n’a pas entraîné de gain de qualité des images ni de détectabilité des métastases pulmonaires, par contre il a été noté une augmentation significative des taux de comptage par modification de l’angle solide de détection.
4.1.2.3 Discussion:
Ce résultat paraît en discordance avec les résultats obtenus sur fantôme dans des conditions d’utilisation humaine. Il faut noter toutefois que la principale cause de dégradation en diminuant l’éloignement des têtes sur les études sur grand fantôme a été rattachée à l’augmentation de coïncidences diffusées. Sur des petits animaux de 300 grammes, les phénomènes d ‘atténuation peuvent être négligés et le nombre de coïncidences diffusées n’a rien à voir avec le taux de diffusés rencontré dans les études sur (grand) fantôme ou dans les situations de clinique humaine.
Par contre, l’augmentation du taux de comptage est un élément fondamental à prendre en compte pour les acquisitions de petits animaux. Il faut favoriser les conditions d’acquisition qui améliorent les taux de comptage puisqu’elles améliorent les statistiques de comptages. Cet aspect est d’autant plus important que les images sont souvent réalisées à des temps importants après l’injection correspondant parfois à 2 ou 3 périodes du 18F ce qui entraîne une diminution de l’activité d’un facteur 4 ou 8.
L’augmentation de l’angle solide (Knoess 2003) Ω peut être calculée par la formule :
Ω = 4π sin (tan–1(A/D))
avec A : la largeur axiale maximale couverte par les détecteurs (soit 33cm)
et D : la distance entre les 2 détecteurs (soit 35 cm ou 15 cm)
Le calcul théorique donne un facteur d’amélioration (F) de 73 % qui correspond avec les données expérimentales obtenues avec les rats. Des mesures de confirmation, réalisées avec une source ponctuelle de 22Na acquise et mesurée avec un rayon de 10 et 35 cm retrouvent des résultats tout à fait comparables.
4.1.3 Spectrométrie et angles d’acceptance
4.1.3.1 Objectif :
L’objectif était d’optimiser les paramètres d’acquisition et d’évaluer le meilleur compromis entre les différents paramètres suivants :
4.1.3.2 Méthode :
En se plaçant dans des conditions cliniques, nous voulions déterminer le meilleur compromis d’acquisition qui permettait de localiser correctement le plus de métastases pulmonaires d’un rat sacrifié juste après son passage sous la caméra. L’analyse macroscopique et microscopique du rat sacrifié est considéré comme l’examen de référence en donnant le nombre et la localisation des métastases pulmonaires.
Une greffe d’ostéosarcome a été réalisée sur la cuisse droite de 2 rats, 4 semaines auparavant.
Les rats avaient un poids compris entre 250 et 300 g au moment de l’examen scintigraphique.
Une activité de 111 MBq (3 mCi) de FDG était injectée dans une veine de la queue des rats endormis.
Sous anesthésie générale (Isoflurane à 4% et O2 à 4L/mn), les rats étaient placés sous la caméra pour une acquisition avec un rayon d’acquisition de 10cm, 3 heures après l’injection.
L’acquisition en mode liste comprenait 30 projections de 50 secondes corrigées de la décroissance. Le mode liste est un mode qui permet d’enregistrer toutes les données brutes qui sont réarrangées, dans un deuxième temps, avec un traitement spécifique et modification des différents paramètres à tester :
- Spectrométrie : fenêtre de 10 %, 20 % ou 30 % centrée sur le pic photoélectrique 511 keV ou de 30% sur le Compton à 320 keV.
- Fenêtre de Coïncidence :
Reconstruction des projections par algorithme itératif OSEM à 4 itérations, EMML à 10, EMML à 20 et EMML à 50 itérations avec et sans filtrage par un filtre passe-bas (ordre 2, seuillé à 0.3).
Après le passage sous la caméra, les deux rats étaient sacrifiés et les poumons examinés. Le résultat de l’analyse des poumons ne révélait la présence de métastases que sur un rat (rat blanc). Seules, les données de l’acquisition en mode liste de ce rat métastatique, ont été traitées et analysées avec tous les différents paramètres d’acquisition et de reconstruction à tester. Le deuxième rat non métastatique ne pouvait pas être utilisé pour comparaison compte tenu des critères retenus.
Les projections acquises en mode liste étaient traitées en fonction des différents paramètres de spectrométrie et d’angles d’acceptance et les données reconstruites avec les différents algorithmes à tester.
A partir de coupes frontales et transverses de 2,1 mm d’épaisseur, plusieurs paramètres étaient calculés en dessinant une ROI sur la métastase visible et une ROI sur une région contrôle thoracique représentative du bruit de fond (BDF):
Le signal maximum = maximum dans la ROI/ moyenne du BDF
Smax = ROImax / BDFmoy
Le signal maximum = maximum dans la ROI/ moyenne du BDF
Smoy = ROImoy / BDFmoy
Le contraste maximum = (maximum dans la ROI- moyenne du BDF) / moyenne du BDF
Cmax = (ROImax - BDFmoy) / BDFmoy
Le contraste moyen = (moyenne dans la ROI- moyenne du BDF) / moyenne du BDF
Cmax = (ROImoy - BDFmoy) / BDFmoy
4.1.3.3 Résultats anatomo-pathologiques :
Le poumon droit pesait 1,2g et mesurait 2,5cm x 1cm x 1cm et comportait deux nodules blanchâtres de 0,5 cm au lobe moyen
Le poumon gauche pesait 0,7g et mesurait 2cm x 1cm x 0,5cm et comportait un nodule blanchâtre au lobe supérieur
L’examen microscopique confirmait l’origine métastatique des lésions bilatérales avec présence d’emboles tumoraux artériels pulmonaires. L’aspect indifférencié des tumeurs était compatible avec un sarcome.
Figure 4-1 : Examen macroscopique du bloc cœur-poumon.
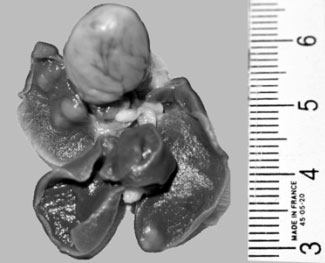
4.1.3.4 Résultats scintigraphiques :
4.1.3.4.1 Effets de l’algorithme de reconstruction et du filtre passe-bas
| Paramètres de reconstruction | S moyen | C max | S max | C moyen | moyenne ROI |
Moyenne BDF |
| EMML 50 | 2,36 | 3,44 | 2,44 | 1,36 | 109 | 46 |
| EMML 50 + LP | 2,27 | 3,18 | 2,18 | 1,27 | 104 | 46 |
| EMML 20 | 2,26 | 3,19 | 2,19 | 1,26 | 104 | 67 |
| EMML 20 + LP | 2,2 | 3,01 | 2,01 | 1,2 | 101 | 67 |
| EMML 10 | 2,14 | 2,93 | 1,93 | 1,14 | 99 | 67 |
| EMML 10 + LP | 2,1 | 2,81 | 1,81 | 1,1 | 97 | 67 |
| OSEM 4 | 2,34 | 3,4 | 2,4 | 1,34 | 108 | 67 |
| OSEM 4 + LP | 2,25 | 3,16 | 2,16 | 1,25 | 104 | 66 |
Les sigles EMML et OSEM désignent les modes de reconstruction itératifs utilisés. LP indique l'utilisation d'un filtre passe-bas, les nombres 4, 10, 20, 50 le nombre d'itérations.
| Paramètres de reconstruction | S moyen | C max | S max | C moyen | moyenne ROI |
Moyenne BDF |
| EMML 50 | 1,61 | 2,44 | 1,44 | 0,61 | 109 | 68 |
| EMML 50 + LP | 1,53 | 2,27 | 1,27 | 0,53 | 102 | 67 |
| EMML 20 | 1,52 | 2,33 | 1,33 | 0,52 | 102 | 67 |
| EMML 20 + LP | 1,5 | 2,16 | 1,16 | 0,5 | 100 | 67 |
| EMML 10 | 1,45 | 2,1 | 1,12 | 0,45 | 97 | 67 |
| EMML 10 + LP | 1,44 | 1,99 | 0,99 | 0,44 | 96 | 67 |
| OSEM 4 | 1,55 | 2,49 | 1,49 | 0,55 | 104 | 67 |
| OSEM 4 + LP | 1,54 | 2,32 | 1,32 | 0,54 | 101 | 66 |
Pour une même reconstruction, avec un filtre passe-bas la valeur de Smoyen/bdfmoyen était inférieure à la valeur initiale. Ce qui est normal car un filtre passe-bas atténue les hautes fréquences donc atténue les contours. Il crée donc un effet de flou ce qui a pour conséquence d'étaler la région sélectionnée de la 1ère image et la surface étudiée étant identique, l'intensité de cette surface diminue après filtrage.
En considérant les reconstructions, sans utilisation de filtre, pour un même mode de reconstruction, la valeur de Smoyen/bdfmoyen diminuait avec le nombre d'itérations. Ce qui est normal, car en diminuant le nombre d'itérations, on diminue le nombre de comparaisons entre projections supposées et projections enregistrées donc l'intensité de la région d'intérêt est plus éloignée de sa valeur réelle (on peut faire la même remarque pour les reconstructions avec utilisation de filtre). De plus, le rapport Smoyen/bdfmoyen mesuré avec OSEM 4 était très légèrement inférieur à la valeur mesurée avec EMML 50 ce qui signifiait que EMML 50 était le meilleur mode de reconstruction et que OSEM 4 en était très proche avec l'avantage d'être beaucoup plus rapide. Ces remarques concernaient les résultats sur coupes frontales et transverses.
Pour étudier l'influence de différents paramètres sur les images obtenues après reconstruction, on a pris les images reconstruites à partir de l'algorithme EMML 20 car il présentait un bon compromis entre rapidité et qualité d'image.
4.1.3.4.2 Effets de la largeur de la fenêtre spectrale et des modes de coïncidence
| Paramètres d’acquisition | S moyen | C max | S max | C moyen | Moyenne ROI |
Moyenne BDF |
| PP 30 12 32 | 2,54 | 3,88 | 2,88 | 1,54 | 108 | 43 |
| PP 20 12 32 | 2,51 | 3,78 | 2,78 | 1,51 | 94 | 37 |
| PP 15 12 32 | 2,44 | 3,88 | 2,88 | 1,44 | 83 | 34 |
| PP 10 12 32 | 2,39 | 3,73 | 2,73 | 1,39 | 58 | 24 |
| PC 30 12 32 | 2,29 | 3,41 | 2,41 | 1,29 | 123 | 54 |
| CC 30 12 32 | 1,75 | 4,69 | 3,69 | 0,75 | 5 | 3 |
| Paramètres d’acquisition | S moyen | C max | S max | C moyen | Moyenne ROI |
Moyenne BDF |
| PP 30 12 32 | 1,32 | 1,78 | 0,78 | 0,32 | 101 | 77 |
| PP 20 12 32 | 1,3 | 1,78 | 0,78 | 0,3 | 88 | 69 |
| PP 15 12 32 | 1,31 | 1,83 | 0,83 | 0,31 | 79 | 60 |
| PP 10 12 32 | 1,29 | 1,95 | 0,95 | 0,29 | 55 | 43 |
| PC 30 12 32 | 1,26 | 1,7 | 0,7 | 0,26 | 119 | 94 |
| CC 30 12 32 | 1,29 | 2,44 | 1,44 | 0,29 | 5 | 4 |
Pour étudier l'influence du type et de la largeur de la fenêtre spectrale :
- PP signifiait que, seuls les photons proches du pic photoélectrique à 511 keV, étaient pris en compte.
- CC signifiait que seuls les photons ayant subi une diffusion Compton dans le cristal étaient pris en compte.
- PC signifiait que les 2 types de photons précédents étaient pris en compte.
- Le 1er nombre indique la largeur de la fenêtre spectrale centrée sur le pic.
Figure 4-2 :Variation de la fenêtre spectrométrique de l’acquisition.
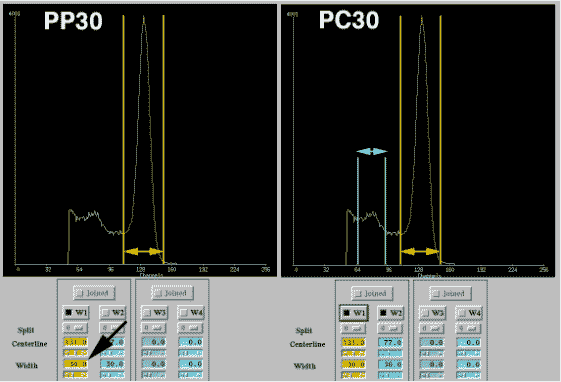
- PP30 : la largeur de la fenêtre de 30 % est centrée sur le pic photoélectrique à 511 keV avec acceptation de coïncidences uniquement de type pic photoélectrique/pic photoélectrique.
- PC30 : deux fenêtres spectrométriques sont retenues. Avec une largeur de 30 % centrée sur le pic photoélectrique à 511 keV et sur le front Compton à 360 keV avec acceptation de coïncidences du type « pic photoélectrique / pic photoélectrique » ou du type « pic photoélectrique/ Compton ».
Figure 4-3 : Variation de la fenêtre spectrométrique dans une acquisition en mode liste d’un rat greffé avec un ostéosarcome (J29) et présentant des métastases pulmonaires confirmées.
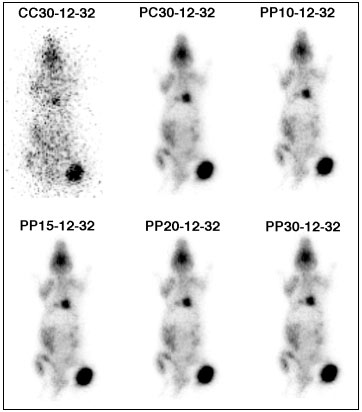
Le 1er nombre indique la largeur de la fenêtre spectrale centrée sur le pic photoélectrique à 511 keV pour les PP (par exemple, 30 signifiait 30% de 120 keV soit 36 keV, c'est à dire, pour les PP, une fenêtre spectrale située entre 511-36/2 = 493 keV et 511+36/2 = 529 keV car elle était centrée sur le pic photoélectrique à 511 keV), sur le front Compton (entre 280 et 340 keV) pour les CC. Dans le cas des PC, il y avait 2 fenêtres spectrales centrées sur le pic photoélectrique à 511 keV et sur le front Compton.
Le 2e nombre indique l'angle d'acceptance axial et le 3e l'angle d'acceptance transverse.
Dans les tableaux 3 et 4, on fixe ces 2 derniers paramètres.
Globalement, on constatait que la valeur de Smoyen/bdfmoyen était la plus élevée pour le mode PP, ensuite pour le mode PC et enfin pour le mode CC.
En effet, pour le mode PC, il y avait plus de coïncidences vraies prises en compte mais aussi plus de coïncidences aléatoires et diffusées donc plus de bruit de fond ce qui faisait diminuer la valeur de Smoyen/bdfmoyen par rapport à celle mesurée pour le PP.
Pour le CC, il y a très peu de photons détectés avec une part importante de coïncidences aléatoires et diffusées ce qui expliquait la faible valeur de Smoyen/bdfmoyen. Pour la coupe transverse, celle-ci était supérieure à celle du PC mais ce résultat daitev être nuancé par le très faible nombre de photons détectés ce qui pouvait engendrer de grandes variations des différents paramètres.
Dans l'ensemble, pour les 2 types de coupes, le type de fenêtre spectrale le plus intéressant était le mode PP, ensuite le PC et enfin le CC.
La valeur du bruit de fond et celle de l'intensité de la région d'intérêt augmentaient avec la largeur de la fenêtre spectrale car plus elle était large. Plus le nombre de photons détectés était important, plus le nombre de coïncidences vraies (intensité de la région d'intérêt) et de coïncidences aléatoires et diffusées (bruit de fond) était élevé pour la coupe frontale. Mais, l'augmentation du dernier paramètre étant plus rapide que celle du 1er (il y avait plus de coïncidences vraies détectées mais encore plus de coïncidences aléatoires et diffusées) la valeur de Smoyen/bdfmoyen augmentait avec la largeur de la fenêtre spectrale. Pour la coupe transverse, les valeurs de Smoyen/bdfmoyen étaient trop proches pour pouvoir en tirer des conclusions mais elles devraient suivre la même évolution que pour la coupe frontale.
La combinaison PP 30 apparaissait la meilleure parmi celles qui ont été étudiées.
4.1.3.4.3 Effets de la variation de la fenêtre spectrale
| Paramètres d’acquisition | S moyen | C max | S max | C moyen | Moyenne ROI |
Moyenne BDF |
| PP 30 8 8 | 2,26 | 3,66 | 2,66 | 1,26 | 23 | 10 |
| PP 20 8 8 | 2,31 | 4,25 | 3,25 | 1,31 | 24 | 10 |
| PP 10 8 8 | 2,33 | 4,54 | 3,54 | 1,33 | 13 | 5 |
| Paramètres d’acquisition | S moyen | C max | S max | C moyen | Moyenne ROI |
Moyenne BDF |
| PP 30 8 8 | 1,38 | 2,37 | 1,37 | 0,38 | 23 | 16 |
| PP 20 8 8 | 1,38 | 2,69 | 1,69 | 0,38 | 22 | 16 |
| PP 10 8 8 | 1,42 | 2,29 | 1,29 | 0,42 | 13 | 9 |
On fixait 2 nouveaux angles d'acceptance axial et transverse égaux tous les 2 à 8°.
Pour les 2 coupes, l'intensité dans la région d'intérêt et le bruit de fond diminuaient avec la largeur de la fenêtre spectrale. Mais dans ce cas, la valeur de Smoyen/bdfmoyen augmentait lorsque la fenêtre spectrale diminuait. Cela pouvait s'expliquer par le faible nombre de photons détectés par rapport aux cas précédents. Cette différence était comparable à celle entre le PC et le CC pour la coupe transverse vue précédemment.
4.1.3.4.4 Effets de la variation de l’angle d’acceptance transverse
| Pramètres d’acquisition |
S moy | C max | S max | C moy | Moyenne ROI |
Moyenne BDF |
| PP 30 12 32 | 2,47 | 3,57 | 2,57 | 1,47 | 105 | 42 |
| PP 30 12 24 | 2,52 | 3,84 | 2,84 | 1,52 | 76 | 30 |
| PP 30 12 16 | 2,53 | 3,72 | 2,72 | 1,53 | 50 | 19 |
| PP 30 12 12 | 2,48 | 4,05 | 3,05 | 1,48 | 38 | 15 |
| PP 30 12 8 | 2,19 | 3,52 | 2,52 | 1,19 | 24 | 11 |
| Pramètres d’acquisition |
S moy | C max | S max | C moy | Moyenne ROI |
Moyenne BDF |
| PP 30 12 32 | 1,44 | 2,14 | 1,14 | 0,44 | 111 | 77 |
| PP 30 12 24 | 1,42 | 2,13 | 1,13 | 0,42 | 81 | 57 |
| PP 30 12 16 | 1,45 | 2,16 | 1,16 | 0,45 | 54 | 38 |
| PP 30 12 12 | 1,42 | 2,27 | 1,27 | 0,42 | 39 | 28 |
| PP 30 12 8 | 1,47 | 2,45 | 1,45 | 0,47 | 25 | 17 |
On faisait varier l'angle d'acceptance transverse, en se plaçant en mode PP 30 avec un angle d'acceptance axial de 12°. Pour les coupes transverses et frontales, l'intensité de la région d'intérêt et du bruit de fond diminuaient avec l'angle d'acceptance transverse. En effet, les photons arrivant sur le détecteur avec un angle par rapport à la normale au détecteur supérieur à l'angle d'acceptance transverse n’étaient pas enregistrés. Ceci était vrai, aussi, au niveau axial (cf plus loin). Ainsi, en diminuant l'angle d'acceptance transverse, le nombre de coïncidences vraies diminuait (l’intensité de la région d'intérêt aussi) et le nombre de coïncidences aléatoires et diffusées (bruit de fond) mais au prix une diminution des statistiques de comptage. La variation de Smoyen/bdfmoyen n’était pas uniforme. Pour la coupe frontale, ce paramètre augmentait puis diminuait tandis que pour la coupe transverse, il oscillait lorsque l'angle d'acceptance transverse diminuait.
En considérant les valeurs pour les 2 coupes, 16° paraissait être le meilleur angle d'acceptance transverse parmi ceux étudiés.
4.1.3.4.5 Effets de la variation de l’angle d’acceptance axial
| Paramètres d’acquisition |
S moy | C max | S max | C moy | Moyenne ROI |
moyenne BDF |
| PP 30 28 32 | 2,27 | 3,09 | 2,09 | 1,27 | 122 | 54 |
| PP 30 24 32 | 2,37 | 3,1 | 2,1 | 1,37 | 123 | 52 |
| PP 30 18 32 | 2,41 | 3,21 | 2,21 | 1,41 | 116 | 48 |
| PP 30 12 32 | 2,48 | 3,46 | 2,46 | 1,48 | 110 | 44 |
| PP 30 6 32 | 2,47 | 3,45 | 2,45 | 1,47 | 83 | 34 |
| PP 30 2 32 | 2,42 | 3,51 | 2,51 | 1,42 | 36 | 15 |
| Paramètres d’acquisition |
S moy | C max | S max | C moy | Moyenne ROI |
moyenne BDF |
| PP 30 28 32 | 1,44 | 1,99 | 0,99 | 0,44 | 131 | 91 |
| PP 30 24 32 | 1,4 | 1,79 | 0,79 | 0,4 | 123 | 88 |
| PP 30 18 32 | 1,4 | 1,79 | 0,79 | 0,4 | 116 | 83 |
| PP 30 12 32 | 1,4 | 1,93 | 0,93 | 0,4 | 109 | 78 |
| PP 30 6 32 | 1,42 | 1,94 | 0,94 | 0,42 | 85 | 60 |
| PP 30 2 32 | 1,44 | 2,06 | 1,06 | 0,44 | 37 | 26 |
Dans le mode PP 30 avec un angle d'acceptance transverse de 32°, les mêmes résultats étaient enregistrés. Les raisons des diminutions de l'intensité dans la région d'intérêt et du bruit de fond avec la diminution de l'angle d'acceptance axial, étaient identiques à celles énoncées précédemment. La variation du paramètre Smoyen/bdfmoyen était assez aléatoire : passant par un maximum pour un angle d'acceptance axial de 6° mais la valeur de ce paramètre pour un angle de 12° était très proche de la valeur maximum et de plus, le nombre de photons détectés était plus important.
4.1.3.4.6 Zoom et Matrice d’acquisition
Dans l'ensemble, le meilleur angle d'acceptance axial semblait être 12°.
Sur le même rat avec un ostéosarcome greffé présentant des métastases pulmonaires et sur la même acquisition, nous avons fait varier le zoom de 1 à 3 et les matrices de 1282 à 2562.
Résultats : l’augmentation de la taille des matrices entraînait une augmentation des temps de reconstruction d’un facteur 4 sans aucune amélioration significative de la qualité de l’image bien au contraire. Compte tenu de la résolution spatiale de la machine et du nombre de coïncidences enregistrés pour l’activité pourtant importante injectée (111 MBq soit 3 mCi pour un rat de 250g avec un délai d’attente de 3h), l’augmentation de matrice ne fait que diminuer les statistiques de comptage par pixel d’un facteur 4, et amplifier le bruit lors des reconstructions itératives.
L’augmentation du zoom permet de reconstruire avec des coupes plus fines bien en dessous de résolution spatiale de la machine. Le zoom de 2 permet de reconstruire avec des coupes de 2,1 mm d’épaisseur au lieu de 4,2 mm d’épaisseur pour un zoom de 1, ce qui est par contre intéressant pour la visualisation de petits animaux de 100 à 300g et pour des animaux de moins de 100g un zoom de 2,5 à 3 permet d’obtenir images plus interprétables. L’augmentation de zoom ne s’accompagne d’aucune amélioration de pouvoir résolutif de la machine, mais permet donc une visualisation plus facile des petits animaux.
Figure 4-4 : Rat porteur d’une greffe d’ostéosarcome avec une métastase pulmonaire droite.
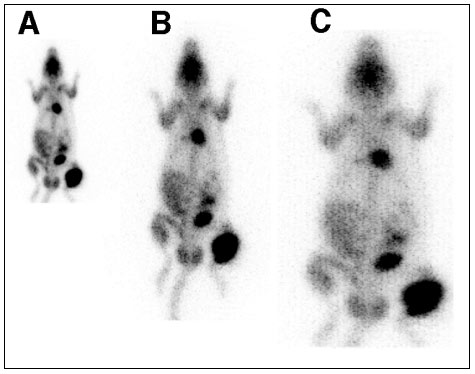
L’acquisition a été réalisée 3h post injection de 370 MBq (10 mCi) de FDG et les données enregistrées en mode liste ont été reconstruites avec différents paramètres.
A) acquisition avec un zoom de 2 et une matrice en 1282
(B) acquisition avec un zoom de 3 et une matrice en 1282
(C) acquisition avec un zoom de 2 et une matrice en 2562
4.1.3.4.7 Conclusion
L'étude réalisée permet de préciser la reconstruction et le traitement d'image optimal pour l’exploration animale. En effet, une image reconstruite avec les algorithmes EMML 50 ou OSEM 4 (avec un avantage pour OSEM 4 pour la rapidité) et avec une fenêtre spectrale de type PP, de largeur 30%, des angles d'acceptance transverse et axial respectivement de 16 et 12° paraît être la meilleure d'un point de vue théorique.
Cette étude concernait uniquement des données quantitatives théoriques. En effet, pour certaines images, même si l'intensité dans la région d'intérêt était élevée, le bruit de fond l'était aussi, ce qui donnait une qualité d’image moyenne et la détection des métastases n'était plus optimale. C'est pour cette raison que dans certains cas, d'un point de vue pratique, il est préférable d'imposer des limites plus strictes (angles d'acceptance, fenêtre d'acceptance …), car, même si le système détecte moins de photons, les photons détectés sont issus de coïncidences vraies ce qui a pour conséquence d'atténuer le bruit de fond et de permettre une détection plus précises des lésions tumorales
4.1.4 Fantôme de petit animal
Mesures : Il a été réalisé des acquisitions avec un fantôme pour petit animal. Le dispositif, contenant des inserts cylindriques froids, est remplissable par une solution radioactive . Ce fantôme de petit animal nous a été gracieusement prêté par M. le Professeur Jean-Noël Talbot du service de Médecine Nucléaire de l’Hôpital Tenon
Le fantôme est composé d’un cylindre 4,5 cm de diamètre intérieur et de 5,0 cm de diamètre extérieur. Ce fantôme contient des cylindres pleins en polycarbonate de 6 diamètres différents (1.2, 1.6, 2.4, 3.2, 4.0 et 4.8 mm) répartis en 6 secteurs (Micro Deluxe, Data Spectrum Corporation, Hillsborough) et il peut être rempli par une solution radioactive.
Le cylindre rempli d’une solution dont l’activité de 18FDG était de 37 MBq (1 mCi), était placé sous la caméra dans les mêmes conditions d’examen que pour les petits animaux.
Les conditions d’acquisition étaient les suivantes :
- Rayon des têtes de 10cm et de 35cm
- Acquisition en mode liste pour permettre le traitement a posteriori des données d’acquisition.
Résultat: en faisant varier tous les paramètres d’acquisition, il a été impossible de visualiser les cylindres pleins froids.
Figure 4-5 : Image de scintigraphie au 18FDG du fantôme Micro Deluxe®.
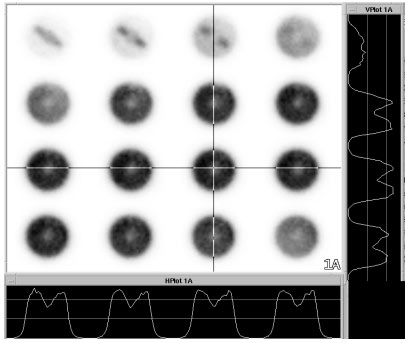
Conclusion : La caméra TEDC ne permet pas de différencier des contrastes négatifs pour des diamètres inférieurs 4,8 mm.
4.1.5 Conclusion
D’un point de vue pratique et en intégrant la qualité de l’image pour son interprétation finale, le compromis acquisition/traitement pour l’imagerie de petits animaux de 100 à 300g sur notre machine TEDC correspond à une acquisition :
- en mode de coïncidence Pic photoélectrique/ Pic photoélectrique
- avec une largeur de fenêtre spectrale de 30% centrée sur 511 keV
- un angle d’acceptance transverse de 16° et axiale de 12°
- une matrice en 128 x 128
- un zoom compris entre 2 et 2,5 en fonction du poids des animaux
- et avec une reconstuction par l’algorithme EMML avec 20 itérations.
La caméra TEDC ne peut pas être utilisée pour détecter des hypofixations et des contrastes négatifs pour l’exploration de petits animaux. Heureusement, les signaux qui nous intéressent sont des hyperfixations et des contrastes positifs qui sont plus faciles à détecter sur des machines de résolution limitée.
4.2 Choix de l’espèce animale et modèles expérimentaux
4.2.1 Souris
Dans un premier temps, nous avons voulu tester la souris.
Le choix de la souris s’explique par la facilité de manipulation de l’animal, par le nombre de modèles expérimentaux décrits dans la littérature et facilement disponibles.
4.2.2 Modèle de Mélanome
4.2.2.1 Lignées tumorales (B16F10)
La lignée cellulaire B16F10 provenait du laboratoire INSERM du centre anticancéreux de Toulouse (Dr Perron). Cette lignée tumorale est validée sur modèle de souris syngéniques C57bl6, immunotolérante pour le mélanome. Ces lignées tumorales étaient intéressantes pour leur capacité à métastaser au niveau pulmonaire (Boehm 1998)
Les lignées cellulaires étaient conservées dans l’azote liquide, puis mises en culture sur milieu DMEM supplémenté en streptomycine, penicilline et avec du sérum de veau fœtal (10%). Après décongélation, les cellules étaient centrifugées pour éliminer le surnageant contenant le DMSO, milieu de conservation toxique pour les cellules en culture. Les cellules étaient reprises et ensemencées avec du milieu de culture Dulbecco’s modifié contenant 4 mL de l-glutamine et 1,5 g/L de bicarbonate de sodium avec 4,5 g/L de glucose et 10% de sérum de veau fœtal. Les cellules étaient maintenues en incubation à 37°C et les milieux cellulaires changés à chaque confluence cellulaire. Le rinçage de la culture cellulaire s’effectuait avec du tampon PBS (Dulbecco’s phosphate buffered saline) sans calcium ni magnésium mais avec un mL d’une solution d’EDTA à 0,03 % et de trypsine à 0,025 %. Les cellules étaient laissées dans l’étuve à 37°C avec 5 % de CO2, jusqu’à détachement complet, puis elles étaient redistribuées à 30 % de leur volume dans les différents milieux de culture.
Pour l’injection à l’animal, les lignées cellulaires à confluence étaient trypsinées, puis reprises dans le milieu de culture, avant inoculation à l’animal.
4.2.2.2 Souris C57bl6
L’espèce C57bl6 est caractérisée par son immunotolérance. Nous avons utilisé des femelles âgées de 6 à 8 semaines pesant entre 16 et 18g (centre d’élevage Iffa-Credo, Lyon). Les animaux ont été pris en charge dans l’animalerie du CHU selon les recommandations habituelles (pièce à température ambiante et rythme nycthéméral artificiel). Les souris étaient maintenues à 4 par cage et disposaient d’eau et de nourriture à volonté.
La greffe tumorale était réalisée par injection dans le flanc gauche de 0,5 mL de surnageant, correspondant à 1 million de cellules B16F10. Une semaine après l’injection, une tumeur de quelques millimètres était palpable dans le flanc de l’animal, au niveau du point d’injection. La croissance tumorale était évaluée quotidiennement (par mesure du diamètre tumoral maximal et de son diamètre perpendiculaire) associé à une surveillance pondérale de la souris.
4.2.2.3 Imagerie du modèle de mélanome chez la souris
Les cellules de mélanomes (B16F10)étaient greffées sur 3 souris, 10 jours avant leur passage sous la caméra pour 2 souris et 18 jours pour la troisième. Le jour de l’examen, les 3 souris de 5 semaines pesaient entre 25 et 30g et les tumeurs mesuraient 8x3 mm, 12x12 mm après 10 jours de greffe et 25x25 mm après 18 jours de greffe.
Une activité de 55,5 MBq (soit 1,5 mCi) de FDG (Flucis®, Cisbio international, Gif sur Yvette) était injectée dans une veine de la queue de la souris, 9 heures avant le passage sous la caméra. Ce délai étant imposé par la disponibilité limitée de la machine (après l’activité clinique de routine se terminant vers 19h) et la nécessité d’injecter des activités suffisantes pour avoir assez de signal sous la caméra mais avec un volume faible pour ne pas tuer les souris.
Les acquisitions comprenaient 30 projections (de 6° explorant de 0° à 180°) de 45 secondes (corrigées de la décroissance) en mode liste avec un rayon de 13,5 cm par rapport au centre de rotation.
4.2.2.4 Résultats
Figure 4-6 : Image d’une scintigraphie au 18FDG d’un mélanome greffé sur souris.
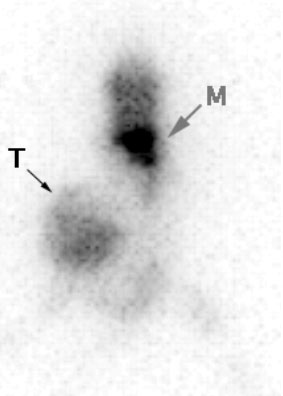
Sur une projection MIP en face antérieure, la tumeur (T) très hypermétabolique est nettement visualisée dans le flanc. Elle présente une fixation hétérogène avec une partie supérieure photopénique, corres-pondant à une zone de nécrose tumorale. La machine est capable de détecter des métastases pulmonaires (M). Cependant, la résolution modeste de la caméra limite l’intérêt de son utilisation dans des études de suivi thérapeutique sur des petits animaux de 30g à 5Og. Le poids et la taille des souris étant des facteurs limitants pour des études animales thérapeutiques, nous avons préféré changer d’espèce et passer sur le rat.
4.2.3 Modèles expérimentaux de rats
4.2.3.1 Ostéosarcome sur rat Sprague-Dawley
4.2.3.1.1 Lignée cellulaire
Les cellules d’ostéosarcome utilisées dans les expérimentations in vitro étaient de la lignée cellulaire CRL 1547 provenant de l’American Type Culture Collection (ATCC, Rockville, Maryland, U.S.A.).
4.2.3.1.2 Modèle animal
Le modèle d’ostéosarcome avait été induit initialement par injection de colloïde radioactif insoluble de 144Cérium (Allouche 1980, Hernigou 1987). Des petits fragments de la partie ostéogénique hyperproliférative de la tumeur avaient été greffés après abrasion du périoste de la région para-tibiale du membre inférieur droit d’un rat Sprague-Dawley. Ce modèle tumoral avait été obtenu à partir d’un ostéosarcome de JP Thiéry (Souche Institut Curie, France) et décrit récemment par Charissoux et al. (Charissoux 1999).
L’espèce Sprague-Dawley avait été choisie parce que le modèle d’ostéosarcome avait été décrit initialement avec cette espèce. Et de façon comparable, plusieurs autres modèles de tumeurs pouvaient être greffées avec de bons résultats sur cette espèce.
En bref, la greffe tumorale était réalisée dans des conditions opératoires standardisées de stérilité et de sécurité. La patte postérieure droite était épilée puis désinfectée par de l’éthanol à 70 %. Une incision latérale était effectuée pour exposer le tibia. Après abrasion du périoste, un fragment tumoral était déposé au contact de la face interne de l’os. L’incision était refermée avec des points de surjet avec des fils non résorbables. Pendant toute la durée de l’intervention, les fragments tumoraux étaient conservés sur glace dans une boîte de Petri contenant du milieu de culture.
4.3.3.2 Chondrosarcome de Swarm sur rat Sprague-Dawley
Le modèle de chondrosarcome utilisé était le chondrosarcome de Swarm. La technique de greffe était superposable, à celle de l’ostéosarcome. Les fragments de chondrosarcome de Swarm avaient été obtenus sur une tumeur congelée, gracieusement confiée par le docteur Heymann du Laboratoire de Physiopathologie de la résorption osseuse de Nantes. Brièvement, le chondrosarcome de Swarm était implanté dans le flanc d’un rat Sprague-Dawley pour obtenir une tumeur évolutive pendant 5 semaines puis la tumeur était retirée et disséquée en petits fragments congelés à –80°C. Un fragment décongelé était greffé sur le tibia droit de rats Sprague-Dawley mâles, âgé de 3 semaines (Grimaud 2002).
4.2.3.3 Mélanome sur rat Sprague-Dawley
4.2.3.3.1 Lignées cellulaire
La lignée cellulaire B16F10 provenait du laboratoire INSERM du centre anticancéreux de Toulouse (Dr Perron). Cette lignée tumorale, validée sur modèle de souris, a été utilisée pour les expérimentations in vitro et pour la greffe tumorale in vivo sur le souris C57bl6 et sur le rat Sprague-Dawley.
4.2.3.3.2 Modèle animal sur rat
Les tumeurs sur rats sont greffées à partir des tumeurs de souris C57bl6 greffées et sacrifiées.
Les souris C57bl6 avaient été greffées dans un premier temps par injection dans le flanc gauche de 0,5 mL de surnageant de culture cellulaire de B16F10, correspondant à 1 million de cellules B16F10. Une semaine après l’injection, une tumeur de quelques millimètres était palpable dans le flanc de l’animal au niveau du point d’injection et 2 semaines après la greffe, la tumeur mesurait plus de 2 cm de diamètre. Les souris étaient sacrifiées et les tumeurs prélevées, dans des conditions stériles sous hotte, puis placées dans un milieu de culture en attendant la greffe. La tumeur était coupée au bistouri en petits morceaux de 2 mm de diamètre et greffée en sous cutanée, sur le flanc des rats Sprague-Dawley âgés de 2 semaines. Les rats Sprague-Dawley greffés nécessitaient une immunodépression par injection intrapéritonéale de Cyclosporine A (Sandimmun 50 mg/mL, Novartis, Rueil-Malmaison, France) à la dose de 20 mg/kg/jour. L’immunosuppression était débutée le jour de la greffe et pendant une semaine l’injection de cyclosporine était quotidienne et après la première semaine les injections étaient réalisée tous les deux jours. La prise de greffe tumorale était observée à partir des 4éme ou 5ème jours post greffe. La tumeur était entretenue par transplantation successive de souris C57bl6 à rat Sprague-Dawley.
Les rats étaient élevés dans des conditions standardisées en accord avec les recommandations de l’établissement. Les animaux étaient élevés à deux par cage et recevaient de l’eau et des aliments à volonté. Le suivi clinique des animaux comprenait la prise de poids et la mesure de la tumeur 2 fois /semaine. Le volume tumoral était estimé par la formule de Carlsson:
V = 1/2 (ab2)
où a est le plus grand diamètre and b le plus petit diamètre de la tumeur (Carlsson 1983).
4.2.3.4 Cancer du sein sur rat Sprague-Dawley femelle
4.2.3.4.1 Lignée cellulaire
La lignée cellulaire MDA-MB-231 est un lignée cellulaire de cancer du sein d’origine humaine n’exprimant pas le récepteur d’œstrogène et isolée initialement sur une atteinte métastatique pleurale d’une femme âgée de 51 ans (Cailleau 1974). Les cellules MDA-MB-231 ont été obtenues auprès de l’European collection of Cell Cultures (ECACC, Salisbury, UK) et maintenues dans un milieu DMEM (Invitrogen Corporation) supplémenté avec 10% de sérum de veau fœtal (Biowhittaker, France) en atmosphère humide sous 5 % de CO2.
4.2.3.4.2 Modèle animal
Des femelles Sprague Dawley, avec un poids de 50-70 g (Centre d’Elevage Depre,France) âgées de 3 semaines, étaient élevées dans l’animalerie du CHU dans des conditions standardisées.
Expérimentations in vivo : toutes les expérimentations étaient réalisées sous anesthésie générale avec de l’oxygène (4 L/min) et 2.5% d’ Isoflurane (Laboratoire Belamont,France ).
Deux modèles de greffe tumorale ont été testés:
Par injection d’une suspension de cellules MDA-MB-231 (groupe A: 5 rats)
Après contrôle de la viabilité cellulaire par la méthode du bleu trypan (> 95%), 107 cellules en suspension dans 100 µL de PBS, étaient injectées dans la glande mammaire de 5 rates.
Par greffe de tumeur solide (groupe B: 5 rats).
Les animaux de groupe B étaient greffés avec une pièce tumorale de 2-4 mm de diamètre en sous cutané dans la région peri-aréolaire. Les greffes tumorales étaient obtenues par une injection préliminaire de 107 cellules en suspension dans 100 µL de PBS dans la graisse musculaire de la région inguinale d’un premier animal. Quand la tumeur atteignait 10 mm de diamètre, elle était excisée, broyée et filtrée stérilement, avant d’être ré-injectée dans la graisse musculaire de nouveaux animaux. Des tumeurs greffées de grande taille (>1 cm) étaient excisées, coupées en petits morceaux de 2 à 4 mm de diamètre, pour être greffés en sous-cutané dans les glandes mammaires des rates du groupe B. A la fin de l’ expérimentation (7 semaines après la greffe), les tumeurs et les principaux organes des animaux des 2 groupes étaient prélevés et conservés dans du formaldehyde, avant d’être et préparés pour analyse microscopique en coupes paraffinées.
L’immunosuppression par cyclosporine A (Sandimmun 50 mg/mL, Novartis, France) était nécessaire pour la prise de greffe tumorale. Les animaux greffés recevaient une injection quotidienne intra-péritonéale (i.p.) de Cyclosporine A (35 mg/kg) pendant 7 semaines. La tumeur était mesurée 3 fois /semaine et les animaux pesés tous les jours. Le volume tumoral était estimé selon la formule de Carlson: V=1/2 (a.b2), où a est le plus grand diamètre b le plus petit.
4.2.3.5 Modèle de foyer inflammatoire aseptique
4.2.3.5.1 Modèle animal
Le modèle de foyer aseptique était provoqué, sous anesthésie générale avec de l’oxygène (4 L/min) et 2.5% d’ Isoflurane (Laboratoire Belamont,France) par l’injection en intramusculaire de 0,2 mL de thérebentine dans une cuisse d’un rat Sprague-Dawley (Centre d’Elevage DEPRE, France). Après 24 heures, une réaction inflammatoire était nettement visible au niveau de la cuisse injectée qui paraissait chaude, enflammée et de volume très augmenté . Cette inflammation était visible pendant au moins 2 semaines mais avec une régression progressive.
4.3 Techniques d’imagerie scintigraphique
4.3.1 Scintigraphie au 18FDG
La technique de scintigraphie au 18FDG a été utilisée en routine de la façon suivante :
- Mise à la diète alimentaire le matin du jour de la scintigraphie (soit 6h avant l’injection de 14h) mais boisson à volonté.
- Injection intraveineuse du radiotraceur 18,5 à 111 MBq (s (de 500µci à 3mCi) de 18FDG (soit Flucis®, Cisbio international, Gif/Yvette ou Glucotep®, Cyclopharma, Toulouse) dans une veine caudale sous anesthésie générale par Isoflurane 4% et Oxygène 5L/mn.
- Temps d’attente entre l’injection et le passage sous caméra entre 3h et 5h dans une cage avec un plateau perforé pour permettre l’écoulement de l’urine. la température de la pièce en était contrôlée pour ne pas être trop basse (ce qui favorise la fixation du FDG par la graisse brune et les muscles du dos).
- Passage sous la caméra sous anesthésie générale (Isoflurane et O2)
- Protection de la machine et du sol par des draps en papier non tissé à usage unique.
- Protocole d’imagerie d’émission biphotonique:
- Rat en procubitus, membres postérieurs vers la caméra
- Acquisition en matrice 128x128
- Spectrométrie 30 %, centrée sur le pic photoélectrique à 511 keV en mode de coïncidence Pic photoélectrique/Pic photoélectrique
- 30 projections de 40 à 60 secondes en fonction de l’activité injectée, du temps d’attente, du poids de l’animal et du nombre d’individus à explorer dans la vacation.
- Zoom d’acquisition de 2
- Réarrangement des données pendant l’acquisition
- Traitement des données
- Reconstruction par algorithme itératif EMML à 20 itérations
- Résultats sous formes de coupes de 2,2 mm d’épaisseur dans les 3 plans de l’espace (transverse, frontal et sagittal) et reconstruction en mode 3D tournant par technique MIP (maximum intensity projection).
- Quantification si nécessaire en dessinant une ROI sur la tumeur et en comparant l’activité enregistrée dans la tumeur et sur le corps entier dans une coupe épaisse corps entier de 28,6 mm d’épaisseur.
4.3.2 Scintigraphie au 18FNa
La technique de scintigraphie au 18FNa utilisée en routine était la suivante :
- Pas de diète alimentaire mais boisson à volonté.
- Injection intraveineuse du radiotraceur de 111 MBq (3 mCi) de 18FNa (18FNa, Cyclopharma, Toulouse) dans une veine caudale sous anesthésie générale par Isoflurane 4% et Oxygène 5L/mn.
- Temps d’attente entre l’injection et le passage sous caméra entre 3h et 5h dans une cage avec un plateau perforé pour permettre l’écoulement de l’urine.
- Passage sous la caméra sous anesthésie générale (Isoflurane et O2)
- Protection de la machine et du sol par des draps à usage unique en papier non tissé.
- Protocole d’imagerie d’émission biphotonique (idem FDG)
- Rat en procubitus, membres postérieurs vers la caméra
- Acquisition en matrice 128x128
- Spectrométrie 30 % centrée sur le pic photoélectrique à 511 keV et en mode de coïncidence Pic photoélectrique/Pic photoélectrique
- 30 projections de 40 à 60 secondes en fonction de l’activité injectée, du temps d’attente, du poids de l’animal et du nombre d’individus explorer dans la vacation.
- Zoom d’acquisition de 2
- Réarrangement des données pendant l’acquisition
- Traitement des données
- Reconstruction par algorithme itératif EMML à 20 itérations
- Résultats sous formes de coupes de 2,2 mm d’épaisseur dans les 3 plans de l’espace (transverse, frontal et sagittal) et reconstruction en mode 3D tournant par technique MIP (maximum intensity projection).
- Quantification si nécessaire en dessinant une ROI sur la tumeur et en comparant l’activité enregistrée dans la tumeur et sur le corps entier dans une coupe épaisse corps entier de 28,6 mm d’épaisseur.
4.3.3 Angioscintigraphie
La technique de marquage in vivo des hématies autologues du rat était une adaptation des techniques utilisées en routine chez l’homme. Cette technique de marquage au technétium (99mTc), émetteur monophotonique d’un rayon gamma de 140 keV détecté par des gamma-caméra conventionnelles. Pour résumer brièvement, le marquage des membranes des hématies par du technétium est possible en deux temps. D’abord, la membrane des hématies est modifiée in vivo par tannage après injection intra-veineuse de chlorure d’étain pour permettre, dans un deuxième temps, l’adsorption membranaire du technétium injecté par voie veineuse. Après homogénéisation dans la circulation des hématies marquées, on réalisait une scintigraphie du compartiment sanguin.
Technique de marquage :
On utilisait une préparation de pyrophosphate d’étain (Angiocis®, Cisbio International, gif/Yvette) comprenant 20,12 mg de pyrophosphtate de sodium décahydraté et 4,05 mg de chlorure stanneux dihydraté. Le flacon était préparé en ajoutant 1 mL de sérum physiologique puis il était dilué (2V/1V) en prenant 1 ml de la solution préparée dans 2 mL de sérum physiologique. On injectait 100 µL de la solution diluée, de pyrophosphate d’étain, dans une veine caudale du rat. Après un temps d’attente de 3 mn, pour permettre la diffusion du pyrophosphate, on injectait une activité de 3,7 MBq (100µCi) maximum de pertechnétate (99mTcO4--) par la même veine caudale. Les acquisitions scintigraphiques pouvaient être réalisées immédiatement ou de façon différée plusieurs heures après l’injection du pertechnétate.
Résumé de la technique d’angioscintigraphie par marquage des hématies au 99mTcO4-- utilisée:
- Pas de diète alimentaire et boisson à volonté.
- Injection intraveineuse du pyrophosphate dilué et attente de 2 min.
- Injection intraveineuse du 3,7 MBq (100 µCi) de 99mTcO4--, dans une veine caudale sous anesthésie générale par Isoflurane 4% et Oxygène 5L/min.
- Temps d’attente entre l’injection et le passage sous caméra entre 15 min et 1h dans une cage avec un plateau perforé pour permettre l’écoulement de l’urine.
- Passage sous la caméra sous anesthésie générale (Isoflurane et O2).
- Protection de la machine et du sol par des draps à usage unique, en papier non tissé.
- Protocole d’imagerie pour scintigraphie conventionnelle en émission monophotonique
- Rat en procubitus, directement posé sur le collimateur de la gamma caméra protégé par un drap à usage unique et d’une couche absorbante.
- Acquisition en matrice 256x256
- Spectrométrie 20 % centrée sur le pic photoélectrique à 140 keV
- Acquisition statique de 5 minutes en mode pré-temps
- Zoom d’acquisition de 2
4.3.4 Scintigraphie au MIBI
La résistance à la chimiothérapie est la cause principale d’échec de ces traitements. Actuellement, pour des patients de même stade clinique initial, l’efficacité de la chimiothérapie n’est pas prévisible. L’imagerie morphologique par TDM reste l'élément incontournable du bilan initial. D'utilisation plus récente, l’imagerie fonctionnelle au FDG par TEP, améliore le bilan d’extension initial et l’évaluation de la réponse précoce à la chimiothérapie. Mais il n’existe pas de facteur fiable pour prédire la résistance à la chimiothérapie par méthode d'imagerie.
Plusieurs tumeurs ont été décrites comme fixant le MIBI: les tumeurs gliales de haut grade, les lymphomes agressifs, les tumeurs broncho-pulmonaires, les myélomes, les tumeurs mammaires, les sarcomes osseux et les sarcomes des tissus mous… La fixation du MIBI (technetium-99m-méthoxyisobutylisonitrile) dans le cytosol des cellules tumorales s’effectue (i) principalement, par différence de potentiel de la membrane de la cellule et des mitochondries (ii) mais aussi par l’augmentation de la vascularisation tumorale et (iii) par l’augmentation de la perméabilité capillaire.
L’échec de la chimiothérapie est le résultat de résistance intrinsèque (tumeur non chimiosensible) ou de résistance acquise qui se développe pendant la thérapie (tumeur chimiosensible devenant résistante). Une forme de résistance appelée MDR (pour multidrug résistance) peut se développer pour plusieurs familles de chimiothérapies (anthracyclines, vincristine, etoposide et taxanes). Les mécanismes de chimiorésistances sont multifactoriels et peuvent impliquer la diminution de la tropoisomérase II , l’augmentation de glucathion cellulaire et la présence de pompes membranaires comme la P-glucoprotéine (P-gp) et les protéines (MRP1, MRP2, MRP3, MRP4 et MRP5 ) associées au gène de la MDR (Multidrug resistance-related protein).
La quantification de la fixation cellulaire du MIBI peut aider à prédire la réponse à la chimiothérapie en relation avec l’expression de protéines retrouvée dans des lignées chimiorésistantes: la P-gp et les Multidrug resistance-related protein (MRP1, MRP2, MRP3, MRP4 et MRP5). Le MIBI est décrit pour être un substrat de la PGP. Parmi les lignées cellulaires tumorales résistantes, celles qui expriment la PGP, sont 200 à 300 fois plus résistantes au paclitaxel, que les lignées PGP négatives (Barbaris 1998). Plusieurs études sur des lignées cellulaires de cancer du sein, ont montré la corrélation entre l’expression de PGP cellulaire et le relargage extra cellulaire de MIBI. L’efflux transmembranaire de MIBI est aussi corrélé à l’expression de MRP1.
La technique de scintigraphie au 99m Tc-MIBI utilisée était la suivante :
- Pas de préparation particulière.
- Injection intraveineuse du radiotraceur (3mCi) de 99mTc-Sestamibi (MIBI, Dupont-Pharma,) dans une veine caudale sous anesthésie générale par Isoflurane 4% et Oxygène 5L/mn.
- Temps d’attente entre l’injection et le passage sous caméra entre 5 min et 75 min dans une cage avec un plateau perforé pour permettre l’écoulement de l’urine.
- Passage sous la caméra sous anesthésie générale (Isoflurane et O2)
- Protection de la machine et du sol par des draps à usage unique en papier non tissé.
- Protocole d’imagerie pour scintigraphie conventionnelle en émission monophotonique
- Rat en procubitus, directement posé sur le collimateur de la gamma-caméra protégé par un drap à usage unique et d’une couche absorbante.
- Acquisition en matrice 256x256
- Spectrométrie 20 % centrée sur le pic photoélectrique à 140 keV
- Acquisition statique de 5 minutes en mode pré-temps
- Zoom d’acquisition de 2
4.4 Méthodes de quantification
La machine ne disposant ni de système de correction d’atténuation, ni de procédures de calibration, il n’était pas possible de disposer de données quantitatives de fixation en SUV. Il fallait donc trouver un autre paramètre quantitatif permettant de suivre la progression tumorale. Les données tomoscintigraphiques étaient obtenues par reconstruction EMML de 20 itérations en matrice 128x128 (voxel de 10,6 mm3) donnant des coupes de 2,2 mm d’épaisseur dans les 3 axes (transverse, frontal et sagittal). Quand la tumeur était d’un volume suffisant pour ne pas être sous estimée par les effets de volume partiel (soit des tumeurs de diamètre > 1cm), nous avons utilisé une méthode semi-quantitative simple et reproductible.
La méthode semi-quantitative nécessitait plusieurs étapes:
- sommation de 13 coupes fines frontales de 2,2 mm, donnant une coupe épaisse de 28,6 mm. La totalité du corps entier de l’animal était contenue dans cette coupe épaisse.
- une ROI était dessinée sur la tumeur
- le nombre de coups intéressant la tumeur était comparé à la fixation totale de l’organisme appréciée par une ROI englobant la totalité de l’animal.
- le résultat de la captation tumorale était exprimé en pourcentage de la fixation totale.
Exemple de quantification sur un modèle de rat avec un ostéosarcome greffé à J0 sur la cuisse droite. (Figure 4-7).
Des scintigraphies au FDG sont réalisées à J42, J58, J79 et J109 après la greffe d’ostéosarcome (Figure 4-8).
Figure 4-7: Greffe d’ostéosarcome de 4 semaines dans la région pré-tibiale droite.
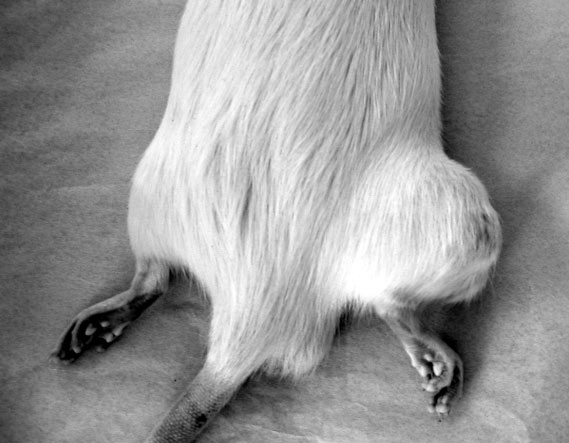
Figure 4-8: Quantification de la captation tumorale en tomoscintigraphie au FDG et par angio-scintigraphie au 99mTc.
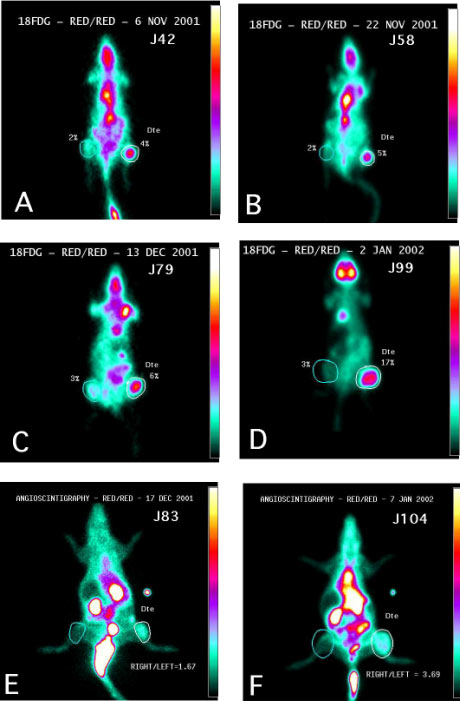
Projections en MIP face antérieure des scintigraphies au FDG à J42 (A), J58 (B), J79(C) et J99 (D) après la greffe d’ostéosarcome.
La fixation tumorale est estimée par comptage des évènements détectés dans la ROI tumorale à droite par rapport à l’activité totale détectée dans l’organisme entier. La même ROI est placée sur la cuisse controlatérale pour estimer de la même manière la fixation non tumorale.
Acquisition planaire en face antérieure d’une angioscintigraphie après marquage des globules rouges autologues du rat par du pyrophosphate d’étain précédant une injection de pertechnétate 99mTcO4-- à J83 (E) et J104 (F) après le greffe.
Figure 4-9 : Représentation graphique de la variation de la fixation de FDG sur une tumeur greffé.
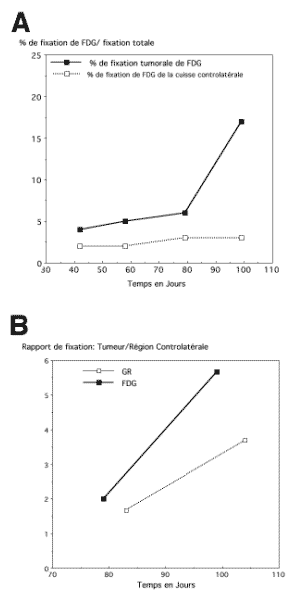
A : La fixation de FDG (exprimée en pourcentage de la fixation totale et comparée à la fixation de la cuisse normale controlatérale). B : Comparaison de la fixation tumorale en FDG et en angioscintigraphie.
Sur la dernière quinzaine de surveillance avant le sacrifice du rat, on compare l’augmentation de la fixation tumorale du FDG à la fixation vasculaire tumorale.
La fixation de FDG est exprimée en rapport du pourcentage de la fixation tumorale par rapport au pourcentage de fixation de la cuisse controlatérale.
La fixation du compartiment vasculaire de la tumeur est exprimée comme le rapport de la fixation du compartiment vasculaire de la cuisse tumorale sur la cuisse controlatérale normale (par angioscintigraphie c’est à dire après marquage des globules rouges du rat).
L’augmentation de la fixation tumorale du FDG n’est pas uniquement corrélée à l’augmentation du volume de la tumeur (estimée de façon indirecte par le volume vasculaire apprécié par l’angiographie) mais surtout à une accélération du métabolisme glucidique.
4.5 Optimisation des paramètres biologiques
4.5.1 Activité d’injection
Compte tenu de la disponibilité variable, de la demi-vie courte et du prix du FDG, il n’a pas été réalisé d’étude spécifique pour déterminer l’activité optimale à injecter chez les animaux.
En tenant compte de l’expérience acquise depuis 1999 sur la machine et du nombre d’explorations scintigraphiques animales réalisées (plus de 300) avec souvent des activités variables en fonction des possibilités de fabrication, de livraison et de disponibilité de la machine après les vacations cliniques (en pratique de 4 MBq à 222 MBq soit de 0,1 à 6 mCi), il se dégage une tendance globale :
Il faut tenir compte de l’irradiation du personnel au moment de l’injection, de la manipulation et de l’acquisition (en tenant compte du fait que les rats sont isolés pendant le temps d’attente entre l’injection et l’acquisition).
La machine ne peut fonctionner qu’en mode 2D avec septa, et des activités importantes peuvent être injectées, sans saturation. Le mode 2D est moins sensible aux phénomènes de temps mort même pour un détecteur constitué d’un cristal d’Iodure de sodium.
Des activités de l’ordre de 222 MBq (6 mCi) sous la machine au moment de l’acquisition sont tout à fait acceptables et sont utilisées dans notre service, en routine pour les patients, ce qui cprrespond à des sources plus étendues.
Pour l’exploration animale où les contraintes dosimétriques sont moins préoccupantes, des activités similaires sont utilisables sans saturer les détecteurs
Le facteur limitant principal est en fait l’activité disponible du radiotraceur. Une activité comprise entre et 18,5 MBq à 37 MBq (soit 0,5 mCi à 1 mCi) pour un animal de 100 g à 300 g paraît être le choix raisonnable correspondant à un bon compromis entre l’activité injectée et l’irradiation du personnel.
4.5.2 Mode d’injection du radiotraceur
Nous avons voulu tester les deux modes d’injection utilisable en expérimentation animale, à savoir l’injection sous cutanée et l’injection intraveineuse.
4.5.2.1 Injection sous cutaneé et intra péritonéale
Les injections sous cutanées et intra-péritonéales présentent l’avantage d’être, techniquement très faciles, reproductibles et réalisables de multiples fois sans aucun problème quels que soient l’âge, la taille ou le poids des animaux. L’inconvénient principal de ces méthodes et qu’elles ne permettent pas une distribution rapide du radiotraceur qui peut séjourner longtemps dans le site d’injection. Cette stagnation du radiotraceur peut rendre difficile l’interprétation de l’examen scintigraphique en particulier pour l’étude de tumeurs expérimentales greffées en sous cutanée dans le flanc ou à la racine des membres. Pour les études de quantification, l’injection du traceur ne pouvant pas être, considérée comme impulsionnelle, les données obtenues sont moins reproductibles et donc difficilement exploitables.
4.5.2.2 Injection intra veineuse (IV)
L’injection intraveineuse est le mode d ‘injection classique des scintigraphies humaines en routine clinique. Elle permet une distribution rapide et homogène du radiotraceur et elle peut, être assimilée à une distribution impulsionnelle du traceur.
En expérimentation animale, ce mode d’injection est le plus souhaitable, mais il nécessite un apprentissage pour pouvoir injecter en intraveineux strict. Ce n’est pas toujours facile, compte tenu de la taille des vaisseaux des petits animaux en particulier pour des rats ou des souris âgés de une à deux semaines.
Les veines disponibles sont les veines de la queue (au nombre de 4) et chez les animaux males les veines péniennes (au nombre de 2). La région péri-orbitaire, traditionnellement utilisée pour les prélèvements sanguins chez la souris n’a pas été retenue pour des raisons techniques puisque les explorations animales étaient programmées dans le cadre de projets de recherche sur la mise au point de nouvelles thérapeutiques anticancéreuses. Ces molécules devaient être injectées, en intraveineux périphérique strict.
4.5.2.3 Comparaison des injections IV et sous cutanées
4.5.2.3.1 Méthodes:
Sur un groupe de 3 rats, un mélanome a été obtenu par greffe sous cutanée de petits morceaux de 2 mm de diamètre, sur le flanc des rats Sprague-Dawley mâles âgés de 2 semaines. La prise de greffe tumorale était observée à partir des 4éme ou 5éme jours post greffe
Les rats Sprague-Dawley greffés nécessitaient une immunosuppression par injection intra-péritonéale de cyclosporine A (Sandimmun 50 mg/mL, Novartis, Rueil-Malmaison, France) à la dose de 20 mg/kg/jour. L’immunosuppression était débutée le jour de la greffe et pendant une semaine, l’injection était de cyclosporine était quotidienne. Après la première semaine, les injections étaient réalisées tous les deux jours. Dans cette série préliminaire, et compte tenue de l’évolution explosive des tumeurs, il avait été décidé d’arrêter l’immuno-supression 7 jours après la greffe. Des scintigraphies au FDG ont été réalisées sur plusieurs jours sur une période allant de 5 à 29 jours après la greffe.
Chaque acquisition était réalisée selon le protocole défini plus haut:
- Mise à la diète alimentaire le matin du jour de la scintigraphie (soit 6h avant l’injection de 14h) mais boisson à volonté.
- Injection intraveineuse de 18,5 MBq (500 µci) ou sous cutanée de 37 MBq (1 mCi) de 18FDG (Flucis®, Cisbio international, Gif/Yvette) dans une veine caudale(voir tableau)., sous anesthésie générale par Isoflurane 4% et Oxygène 5L/mn.
- Les injections à J5 et J11 était réalisées en IV avec une activité de 18,5 MBq (500 µCI) de FDG Les autres jours d’exploration (J6 pour le rat NRR, J15 pour les rats NR et NVB et J28 pour les rats NRR et NVB), les injections étaient réalisées en sous cutanée dans la région thoracique gauche avec une activité de 37 MBq (1 mCi) de FDG.
- Temps d’attente entre l’injection et le passage sous caméra de 5h à 6h30 (voir tableau).
- Passage sous la caméra sous anesthésie générale (Isoflurane et O2)
- Protection de la machine et du sol par des draps à usage unique en papier non tissé
- Protocole d’imagerie d’émission biphotonique:
- Rat en procubitus, membres postérieurs vers la caméra
- Acquisition en matrice 128x128
- Spectrométrie 30 % centrée sur le pic photoélectrique à 511 keV et en mode de coïncidence Pic photoélectrique/Pic photoélectrique
- 30 projections de 40 secondes.
- Zoom de 2
- Réarrangement des données pendant l’acquisition
- Traitement des données
- Reconstruction par algorithme itératif EMML à 20 itérations
- Résultats sous formes de coupes de 2,2 mm d’épaisseur dans les 3 plans de l’espace (transverse, frontal et sagittal) et reconstruction en mode 3D tournant par technique MIP (maximum intensity projection).
- Quantification une ROI sur la tumeur et en comparant l’activité enregistrée dans la tumeur et sur le corps entier dans une coupe épaisse corps entier de 28,6 mm d’épaisseur et sans correction de décroissance compte tenu de l’utilisation d’un rapport de fixation tumorale sur fixation totale.
| Rat | Jour | Injection | Activité en MBq (µCi) | Délai entre l’injection et l’examen | Poids en g | Volume tumoral en mm3 |
| NRR | J5 | intraveineuse | 18,5 (500) | 5h | 70 | 0 |
| J6 | sous cutanée | 37 (1000) | 5h30 | 72 | 23 | |
| J11 | intraveineuse | 18,5 (500) | 5h | 96 | 2 048 | |
| J15 | - | - | - | 110 | 4 400 | |
| J28 | sous cutanée | 37 (1000) | 5h30 | 130 | 500 | |
| NR | J5 | intraveineuse | 18,5 (500) | 5h | 80 | 0 |
| J6 | - | - | - | 84 | 0 | |
| J11 | intraveineuse | 22,2 (600) | 5h | 109 | 75 | |
| J15 | sous cutanée | 37 (1000) | 6h | 123 | 50 | |
| J28 | - | - | - | 152 | 0 | |
| NVB | J5 | intraveineuse | 18,5 (500) | 5h | 62 | 0 |
| J6 | - | - | - | 65 | 0 | |
| J11 | intraveineuse | 18,5 (500) | 5h | 86 | 1 089 | |
| J15 | sous cutanée | 37 (1000) | 6h30 | 123 | 1 437 | |
| J28 | sous cutanée | 37 (1000) | 5h | 135 | 527 |
4.5.2.3.2 Résultats:
Comme on peut le voir sur la figure 4-10 les injections IV étaient préférables aux injections sous cutanées, responsables de fixations parasites très tardives.
Figure 4-10 : Comparaison des examens réalisés après injections sous-cutanées et intra-veineuses.
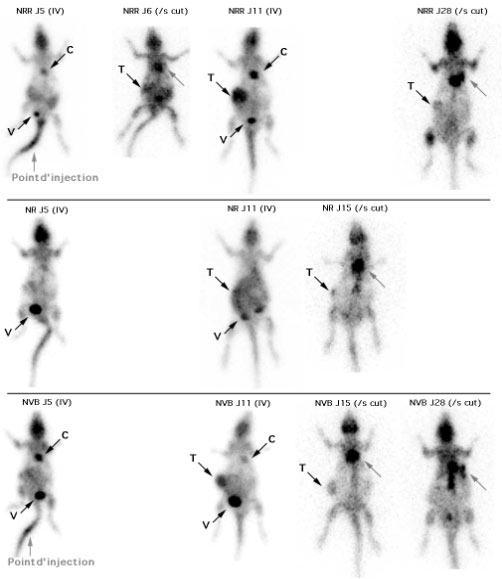
Les trois rats sont présentés en MIP en face antérieure. Le cœur (flèche C) était visible de façon inconstante (malgré la diète), selon les jours ou les animaux de même que la vessie (flèche V). La tumeur greffée sur le flanc droit (flèche T) n’était visible qu’à partir du 5éme jour. La greffe du rat NR (flèche T) était moins évolutive, comme en témoigne aussi sa progression volumique limitée. Pour le rat NVB, la tumeur (flèche T) était bien visible à J11 avec une diminution nette de la fixation et du volume à partir de J15. La diminution de la fixation tumorale des 3 rats était la conséquence de l’arrêt des injections de Cyclosporine A à partir de J7. Les injections IV permettaient d’obtenir des images moins bruitées et avec moins de fixation parasites que les images obtenues après des injections sous cutanées. Les images acquises après injections sous cutanées, présentaient toutes des fixations dans la région de la zone d’injection (flèche grise) et ce alors que le temps d’attente était systématiquement plus important de 30 à 90 minutes par rapport aux images après injection IV. Noter la variation de la taille des rats et du poids (qui doublait) en un mois, sur les images de projection présentées à la même échelle.
4.5.3 Fixation du FDG in vitro
4.5.3.1 Fixation cellulaire du FDG en fonction du temps
4.5.3.1.1 Objectif:
Pour connaître de façon plus rigoureuse les temps d’incubation nécessaire à l’optimisation des scintigraphies au 18FDG nous avons voulu estimer la fixation sur plusieurs lignées cellulaires tumorales et sur des cellules non tumorales, impliquées dans la réponse inflammatoire. Pour les cellules tumorales, nous avons choisi un panel large de différentes lignées tumorales qui comprenait aussi les lignées cellulaires utilisées pour greffer les tumeurs de nos modèles expérimentaux sur petits animaux. Pour les cellules non tumorales impliquées dans les mécanismes inflammatoires, notre choix s’etait porté sur des cellules du sang circulant (macrophages et polynucléaires) obtenues après sédimentation et centrifugation en gradient de Ficoll pour l’exclusion des lymphocytes.
4.5.3.1.2 Méthodes
La fixation de FDG a été évaluée in vitro sur des macrophages et polynucléaires provenant de deux donneurs sains (Macroph A et Macroph B) et sur 8 lignées cellulaires tumorales:
- 2 lignées de tumeur mammaires (MDA-MB-231 et MDA 435),
- une lignée de cellules de mélanome (B16F10),
- une lignée de cellules d’ostéosarcome (CRL 1547),
- 2 lignées de leucémie lymphoblastique à cellules T d’origine humaine (Molt4 et Jurkat),
- une lignée de cellules d’adénocarcinome du colon (HT29)
- et une lignée de cellules de rhabdomyosarcome (9-4.0 RMS).
Toutes les lignées cellulaires tumorales provenaient de l’American Type Culture Collection (ATCC, Rockville, Maryland, U.S.A.) sauf les cellules B16F10, de l’INSERM (Centre Anticancéreux Claudius Regaud, Toulouse, France), et les HT29 de l’INSERM (U239, Paris, France) et les 9-4.0 RMS gracieusement confiées par le Dr Poupon (Institut Curie, Paris, France).
Brièvement, les cellules tumorales étaient ensemencées et comptées dans un milieu RPMI avec une faible concentration de glucose (100 mg/dL). Les cellules étaient incubées 6h dans des plaques de 96 multi-puits à 37°C avant l’expérience qui débutait lorsque les puits contenaient 80 000 cellules. Le FDG était dilué dans du RPMI à la concentration finale de 37 kBq (soit 1µCi) /10µL de RPMI. Dans chaque puit, 40 µL de la solution diluée de FDG était ajoutée au 80 000 cellules pour une incubation de 30, 60, 120 et 300 minutes. Pour chaque temps d’incubation, la fixation cellulaire de FDG était estimée sur 14 puits différents Après l’ incubation, les plaques étaient lavées 3 fois avec un soluté tamponné phosphate (PBS). Après trypsinisation des puits, la radioactivité était récupérée pour être mesurée sur un compteur par mesure des rayons gamma de 511 keV (Cobra 5003 Autogamma, Packard Instrument Company, Meriden, USA). Pour les cellules inflammatoires circulantes les incubations étaient réalisées en milieu liquide dans des petits tubes conique (Eppendorf) et la séparation lavage se faisaient après centrifugation.
La captation cellulaire de FDG de toutes les lignées était exprimée en coups/minute pour 80 000 cellules viables. Chaque temps d’incubation était estimé 14 fois et le résultat exprimé par la moyenne des comptages après exclusion des valeurs aberrantes obtenues par test statistique (test t).
L’évolution quantitative de la fixation cellulaire de FDG par les cellules était exprimée en pourcentage de la variation de captation cellulaire par rapport à la fixation cellulaire à 30 minutes (Figures 4-11).
L’analyse des résultats considérait comme significatives des différences de moyennes de captation cellulaires de FDG dans le temps pour des valeurs de p inférieures à 0.05 (p < 0.05) par le test statistique non paramétrique de Mann et Whittney.
4.5.3.1.3 Résultats
Figure 4-11 : Evaluation in vitro de la fixation cellulaire de FDG en fonction des temps d’incubation allant de 30 minutes à 5 heures
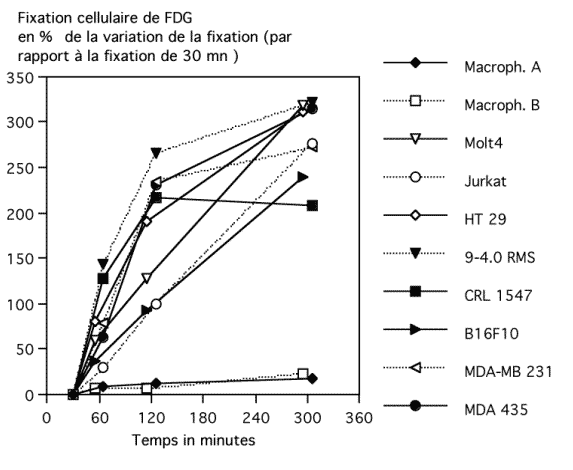
La fixation cellulaire in vitro du FDG était significativement plus élevée après une incubation de 5h et de 2h qu’après une incubation de 1h (p = 0.0002, test de Mann & Whitney) avec les 8 lignées cellulaires tumorales mais pas avec les leucocytes des 2 donneurs sains (Macroph. A et B).
5.5.4 Fixation du FDG in vivo
Pour déterminer le meilleur rapport signal sur bruit, nous avons voulu tester différents temps de passage après l’injection IV de FDG, dans plusieurs modèles expérimentaux de tumeurs greffées sur le rats Sprague-Dawley .
4.5.4.1 Acquisition dynamique (ostéosarcome)
4.5.4.1.1 Technique
Sur le modèle de greffe tumorale d’ostéosarcome de rat Sprague-Dawley non immunodéprimé, nous avons réalisé des scintigraphies dynamiques.
Sur un groupe de 4 rats, l’ostéosarcome était greffé à J0.
Six semaines après la greffe (soit à J42) étaient réalisées des acquisitions tomographiques dynamiques sur les 4 rats, pesant de 200 à 380 grammes.
Les tomoscintigraphies dynamiques correspondaient à des enchaînements de 10 tomoscintigraphies corps entier de 25 minutes (30 projections de 40 secondes corrigées de la décroissance) toutes les 30 minutes de 30 minutes à 5 heures après l’injection de FDG.
Chaque acquisition était réalisée selon le protocole défini plus haut :
- Mise à la diète alimentaire le matin du jour de la scintigraphie (soit 6h avant l’injection de 14h) mais boisson à volonté.
- Injection intraveineuse du radiotraceur de 18,5 MBq à 111 MBq (de 500 µci à 3 mCi) de 18FDG (soit Flucis®, Cisbio international, Gif/Yvette ou Glucotep®, Cyclopharma, Toulouse) dans une veine caudale sous anesthésie générale par Isoflurane 4% et Oxygène 5L/mn.
- Temps d’attente entre l’injection et le pasage sous caméra de 30 minutes.
- Passage sous la caméra sous anesthésie générale (Isoflurane et O2)
- Protection de la machine et du sol par des draps à usage unique en papier non tissé
- Protocole d’imagerie d’émission biphotonique:
- Rat en procubitus, membres postérieurs vers la caméra
- Acquisition en matrice 128x128
- Spectrométrie 30 % centrée sur le pic photoélectrique à 511 keV et en mode de coïncidence Pic photoélectrique / Pic photoélectrique
- 30 projections de 40 secondes.
- Zoom de 2
- Réarrangement des données pendant l’acquisition
- Traitement des données
- Reconstruction par algorithme itératif EMML à 20 itérations
- Résultats sous formes de coupes de 2,2 mm d’épaisseur dans les 3 plans de l’espace (transverse, frontal et sagittal) et reconstruction en mode 3D tournant par technique MIP (maximum intensity projection).
- Quantification une ROI sur la tumeur et en comparant l’activité enregistrée dans la tumeur et sur le corps entier dans une coupe épaisse corps entier de 28,6 mm d’épaisseur et sans correction de décroissance compte tenu de l’utilisation d’un rapport de fixation tumorale sur fixation totale.
4.5.4.1.2 Résultats
Le rapport, signal sur bruit était meilleur sur les acquisition tardives que sur les acquisitions précoces. Les acquisitions dynamiques (correspondant à 10 tomoscintigraphies enchaînées) étaient réalisées toutes les 30 minutes de 1h à 5h après l’injection IV de FDG. Les ostéosarcomes greffés sur 4 rats (Figure 42) captaient proportionnellement plus de FDG (23% ± 13%) sur les acquisitions précoces à 1h par rapport aux acquisitions tardives à. 5h. Cette différence était statistiquement significative (p = 0.02 pour le test non paramétrique de Friedman)
Figure 4-12 : Evolution dans le temps, de la captation de FDG par l’ostéosarcome greffé sur 4 rats.
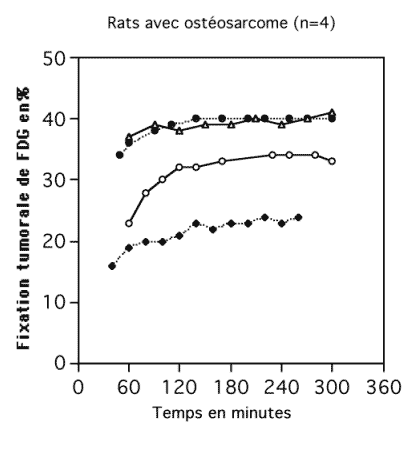
La fixation du FDG par l’ostéosarcomes était estimée par tomoscintigraphie dynamique de 1h à 5h après l’injection IV du radiotraceur.
4.5.4.2 Acquisition en 2 temps: 1h/5h (mélanome)
4.5.4.2.1 Technique
15 rats étaient greffé par mise en place sous cutanée d’une tumeur de mélanome à J0 prélevée sur souris. La tumeur évoluait sous immunosuppression par Cyclosporine A.
À J5 post greffe sur des rats pesant de 100 à 150 grammes, deux scintigraphies étaient réalisées 1h et 5h après l’injection IV de FDG.
Chaque acquisition était réalisée selon le protocole défini plus haut:
- Mise à la diète alimentaire le matin du jour de la scintigraphie (soit 6h avant l’injection de 14h) mais boisson à volonté.
- Injection intraveineuse de 18,5 MBq (500 µci) de 18FDG (Flucis®, Cisbio international, Gif/Yvette) dans une veine caudale(voir tableau)., sous anesthésie générale par Isoflurane 4% et Oxygène 5L/mn.
- Temps d’attente entre l’injection et le passage sous caméra de 1h et 5h.
- Passage sous la caméra sous anesthésie générale (Isoflurane et O2)
- Protection de la machine et du sol par des draps à usage unique en papier non tissé
- Protocole d’imagerie d’émision biphotonique:
- Rat en procubitus avec les membres postérieurs vers la caméra
- Acquisition en matrice 128x128
- Spectrométrie 30% centrée sur le pic photoélectrique à 511 keV et en mode de coïncidence Pic photoélectrique/Pic photoélectrique
- 30 projections de 40 secondes.
- Zoom de 2
- Réarrangement des données pendant l’acquisition
- Traitement des données
- Reconstruction par algorithme itératif EMML à 20 itérations
- Résultats sous formes de coupes de 2,2 mm d’épaisseur dans les 3 plans de l’espace (transverse, frontal et sagittal) et reconstruction en mode 3D tournant par technique MIP (maximum intensity projection).
- Quantification une ROI sur la tumeur et en comparant l’activité enregistrée dans la tumeur et sur le corps entier dans une coupe épaisse corps entier de 28,6 mm d’épaisseur et sans correction de décroissance compte tenu de l’utilisation d’un rapport de fixation tumorale sur fixation totale.
4.5.4.2.2 Résultats
Le rapport signal sur bruit était meilleur sur les acquisition tardives que sur les acquisitions précoces. Pour les 15 rats avec une greffe de mélanome B16F10, (Figure 4-13), la fixation tumorale était significativement plus élevée de 17 à 24 % ce qui correspondait à un pourcentage d’augmentation de captation de 39 ± 37 % de sur les images à 5h par rapport aux images précoces à 1h.
Cette différence de fixation était statistiquement significative (p = 0.027, test non paramétrique de Wilcoxon).
Figure 4-13: Evolution dans le temps de la captation de FDG par un mélanome greffé sur 15 rats.
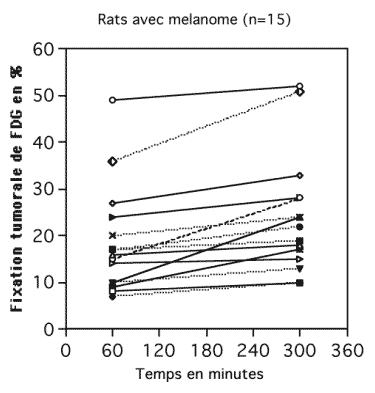
La fixation du FDG par le mélanome était estimée par 2 tomoscintigraphies réalisées 1h et 5h après l’injection IV du radiotraceur.
4.6 Imagerie et études des modèles animaux
4.6.1 Imagerie au 18FNa
Pour préciser l’atteinte métastatique osseuse, on peut utiliser le fluorure de sodium. Lorsque le fluor stable est remplacé par est un isotope radioactif comme le 18F, on dispose d’un radiotraceur émetteur de positon qui reflète l’activité ostéoblastique au niveau du squelette. L ‘intérêt principal d’utiliser un traceur émetteur de positon réside dans le gain de sensibilité et de résolution des dispositifs de détection de coïncidences par rapport aux caméras utilisées pour les scintigraphies osseuses réalisées après injection de diphosphonates marqués au 99mTc. De plus, pour certaines tumeurs qui ne sont pas caractérisées par une augmentation du métabolisme glucidique et qui ont cependant un tropisme métastatique osseux comme c’est décrit pour les adénocarcinomes de la prostate, l’exploration osseuse est plus intéressante qu’une scintigraphie au FDG, peu contributive.
4.6.1.1 Comparaison ostéosarcome vs chondrosarcome
Il peut être intéressant de pouvoir explorer une éventuelle atteinte métastatique osseuse par un traceur du métabolisme osseux émetteur de positon comme le 18FNa. Nous avons voulu étudier la fixation du 18FNa dans deux modèles de tumeurs osseuses greffées sur le rat Sprague-Dawley: l’ostéosarcome et le chondrosarcome.
4.6.1.1.1 Technique
On a exploré par scintigraphie au18FNa et au18FDG sur deux jours consécutifs, deux groupes de rats porteurs d’une tumeur osseuse greffée :
Groupe A : 2 rats porteurs d’un ostéosarcome, l’un non métastatique et l’autre métastatique au niveau pulmonaire de façon bilatérale et étendue, 53 jours après la greffe
Groupe 2 : 2 rats porteurs d’un chondrosarcome non métastatiquse, 73 jours après la greffe.
L’ acquisition au 18FNa était réalisée selon le protocole défini plus haut:
- Pas de diète mais alimentation et boissons à volonté.
- Injection intraveineuse de 148 MBq (4 mCi) de 18FNa (Cyclopharma, Toulouse) dans une veine caudale, sous anesthésie générale par Isoflurane 4% et Oxygène 5L/mn.
- Temps d’attente entre l’injection et le passage sous caméra de 6h.
- Passage sous la caméra sous anesthésie générale (Isoflurane et O2)
- Protection de la machine et du sol par des draps à usage unique en papier non tissé
- Protocole d’imagerie d’émission biphotonique:
- Rat en procubitus membres postérieurs vers la caméra
- Acquisition en matrice 128x128
- Spectrométrie 30% centrée sur le pic photoélectrique à 511 keV et en mode de coïncidence Pic photoélectrique/Pic photoélectrique
- 30 projections de 40 secondes.
- Zoom de 2
- Réarrangement des données pendant l’acquisition
- Traitement des données
- Reconstruction par algorithme itératif EMML à 20 itérations
- Résultats sous formes de coupes de 2,2 mm d’épaisseur dans les 3 plans de l’espace (transverse, frontal et sagittal) et reconstruction en mode 3D tournant par technique MIP (maximum intensity projection).
- Quantification une ROI sur la tumeur et en comparant l’activité enregistrée dans la tumeur et sur le corps entier dans une coupe épaisse corps entier de 28,6 mm d’épaisseur et sans correction de décroissance compte tenu de l’utilisation d’un rapport de fixation tumorale sur fixation totale.
L’ acquisition au 18FDG était réalisée, le lendemain, selon le protocole habituel:
Mise à la diète alimentaire le matin du jour de la scintigraphie (soit 6h avant l’injection de 14h) mais boisson à volonté.
Injection intraveineuse du radiotraceur de 18,5 MBq (500µCi) de 18FDG (Glucotep®, Cyclopharma, Toulouse) dans une veine caudale sous anesthésie générale par Isoflurane 4% et Oxygène 5L/mn.
Temps d’attente entre l’injection et le passage sous caméra de 2h et 15 minutes.
Tous les autres paramètres d’acquisition sont les mêmes que pour l’acquisition au 18FNa.
4.6.1.1.2 Résultats
Les résultats obtenus en détection de coïncidence après injection de 18FNa correspondaient à des images de squelette avec une définition bien meilleure que ce que l’on peut obtenir avec des caméras à scintillation après injection de diphosphonates marqués par un traceur monophotonique. Dans les deux modèles de tumeur osseuse, la résolution des images obtenues permettait de bien distinguer au niveau du rachis, les différentes corps vertébraux. Pour le modèle d’ostéosarcome, la tumeur primitive présentait une fixation importante de 18FNa, correspondant à l’activité ostéoblastique des cellules tumorales. Il est intéressant constater que la tumeur captait différemment le 18FDG et le 18FNa, ce qui rendait bien compte de la différence des processus métaboliques et fonctionnels explorés par chaque radiotraceur. De plus, on constatait que les métastases pulmonaires multiples et bilatérales bien visibles au 18FDG ne présentaient pas toutes une fixation du 18FNa ce qui pouvait être expliqué par la variabilité des métastases pour exprimer une capacité d’ostéogenèse (Figures 4-14, 4-15, 4-16 et 4-17).
Figure 4-14 : Chondrosarcome de swarn
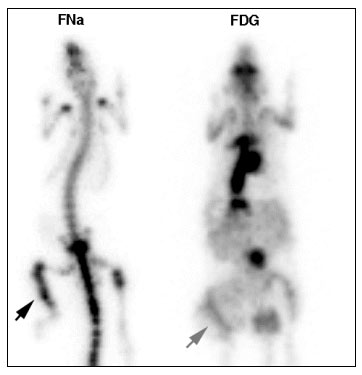
Exploration d’un rat de 450 gammes, 10 semaines après la greffe de chondrosarcome de swarn. Les images sont réalisées le premier jour, 6 heures après injection de 148 MBq (4 mCi) de 18FNa, et le lendemain, 2 heures après injection de 18,5 MBq (0,5 mCi) 18FDG. La tumeur fixe plus le FNa (flèche noire) dans la partie de remodelage osseux que le FDG (flèche grise), ce qui est en accord avec le temps de doublement tumoral faible et avec l’agressivité limitée de la lésion qui n’évolue que localement sans dissémination à distance. On remarquera la fixation para-vertébrale et scapulaire de FDG en rapport avec une fixation de la graisse brune consécutive à l’attente dans une pièce peu chauffée et à la sécrétion de catécholamines en réponse au stress.
Figure 4-15 : Ostéosarcome non métastatique
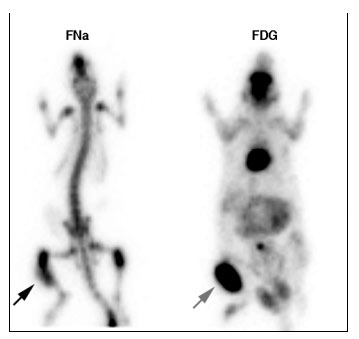
Exploration d’un rat de 440 gammes, 8 semaines après la greffe d’ostéosarcome. Les images sont réalisées le premier jour, 6 heures après injection de 148 MBq (4 mCi) de 18FNa, et le lendemain, 2 heures après injection de 18,5 MBq (0,5 mCi) 18FDG. La tumeur fixe moins le FNa (flèche noire) que le FDG (flèche grise), ce qui est en accord avec l’agressivité de l’ostéosarcome qui ne se limite pas qu’à des phénomènes de remodelage osseux. L’activité ostéoblastique du sarcome est visible par l’exploration au FNa qui ne se superpose pas avec l’activité hypermétabolique de la tumeur explorée par le FDG.
Figure 4-16 : Ostéosarcome métastatique (1)
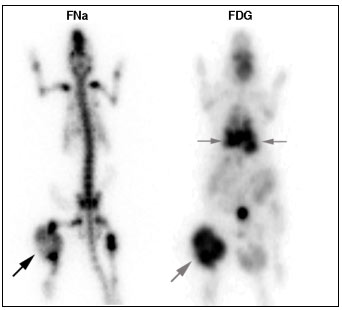
Exploration d’un rat de 430 gammes, 8 semaines après la greffe d’ostéosarcome. Les images sont réalisées le premier jour, 6 heures après injection de 148 MBq (4 mCi) de 18FNa, et le lendemain, 2 heures après injection de 18,5 MBq (0,5 mCi) 18FDG. Sur les images de projection en 3D (MIP), la tumeur fixe moins le FNa (flèche noire) que le FDG (flèche grise). Des métastases pulmonaires bilatérales sont nettement visibles sur les images de FDG (flèches grises horizontales) confirmées par l’analyse histologique réalisée après le sacrifice de l’animal
Figure 4-17 : Ostéosarcome métastatique (2)
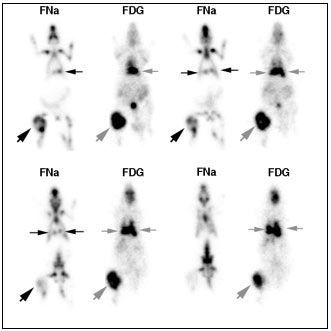
Il faut analyser le même rat précédent, en coupe frontales de 2,2 mm d’épaisseur, pour remarquer la fixation du FNa par les métastases pulmonaires. L’intensité de la fixation du FNa par les métastases est plus faible et moins étendue que la fixation du FDG.
Comme pour la tumeur primitive (flèches larges, grise en FDG et noire en FNa), ) pour les métastases pulmonaires de l’ostéosarcome, il n’y a pas de superposition des parties hypermétaboliques (petites flèches grises au FDG) et des parties ostéoblastiques (petites flèches noires au FNa).
4.6.2 Imagerie au 18FDG
4.6.2.1 Suivi de la croissance tumorale- Modèle d’ostéosarcome
4.6.2.1.1 Objectif :
Connaître la correlation entre la croissance tumorale et la fixation tumorale de FDG.
4.6.2.1.2 Méthode :
Pour savoir si les scintigraphies au FDG permettent un suivi plus précis des modèles tumoraux sur petits animaux, nous avons étudié le modèle d’ostéosarcome greffé sur un groupe de 6 rats Sprague-Dawley non immunodéprimés.
La progression de la maladie était estimée par (Figure 4-18):
4.6.2.1.3 Résultats :
Il était mis en évidence une corrélation importante entre la captation de FDG et le volume tumoral (p < 0.001 pour le test non paramétrique de Spearman)
Si les volumes et la fixation tumorale évoluaient de façon parallèle, la scintigraphie au FDG permettait de préciser l’hétérogénéité tumorale et en particulier de différencier les zones de nécroses hypofixantes des zones de croissance tumorale hypermétaboliques.
Figure 4-18 : Evolution du poids des animaux, du volume et de la captation tumorale du FDG.
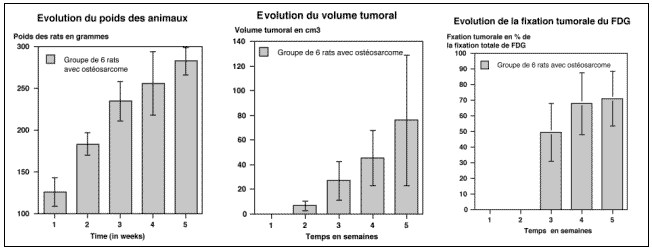
4.6.2.2 Suivi de la croissance tumorale - Modèle de cancer du sein
4.6.2.2.1 Objectif :
Contrôler sur un deuxième modèle, l’évolution tumorale estimée par la fixation de FDG.
Résultats :
Deux exemples pour illustrer l’évolution de la croissance tumorale d’une tumeur du sein après greffe d’une tumeur ou après injection de cellules (Figure 4-9).
Evolution de la captation tumorale du FDG sur deux rates greffées :
- Soit par injection d’une suspension de cellules MDA-MB-231 (groupe A : 5 rats) 107 cellules en suspension dans 100 µL de PBS, étaient injectées dans la glande mammaire de 5 rates.
- Soit par greffe de tumeur solide (groupe B : 5 rats). Les animaux de groupe B étaient greffés avec une pièce tumorale de 2-4 mm de diamètre en sous cutané dans la région peri-aréolaire.
Ce qui correspondait à des animaux de 200g à 250g entre 3 semaines et 5 semaines
La croissance tumorale et la fixation de FDG évoluent de façon corrélée. On note cependant des différences de croissance tumorale et d’aspect macroscopique en fonction du mode de création de la tumeur. La tumeur greffée est plus sphérique et mieux délimitée macroscopiquement que la tumeur obtenue près injection cellulaire qui sont plus diffuses sans limites nettes.
Figure 4-19 : Evolution de cancer du sein obtenu par greffe tumorale (A) et par injection cellulaire (B)
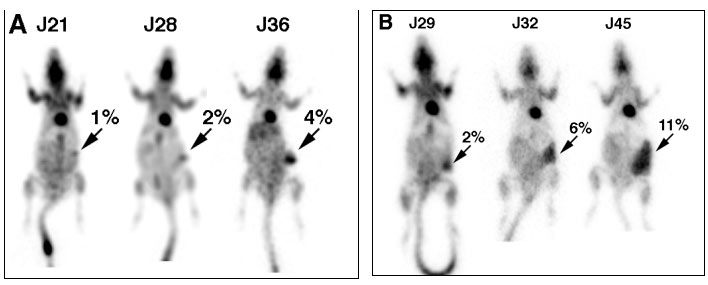
Figure 4-20 : Cancer du sein greffé exploré par FDG et par MIBI
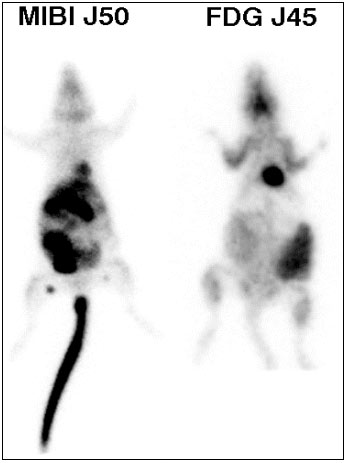
Le cancer du sein a été obtenu par injection cellulaire. Le même animal est exploré après la greffe, à J50 par le MIBI et à J45 par le FDG.
La volumineuse tumeur mammaire présente des caractéristiques hyper-métaboliques sur les acquisitions TEDC au FDG. Elle ne fixe pas le MIBI sur les clichés statiques réalisés de façon précoce (5 min) ou tardive (75 min) après l’injection du radiotraceur. Les cellules tumorales injectées, sont de la lignée cellulaire de cancer du sein MDA-MB-231 décrite comme chimiorésistante. A noter la fixation digestive importante avec le MIBI et la fixation non spécifique au niveau de la queue et des ganglions postérieurs bilatéraux correspondant à des ganglions de drainage lymphatique suite à l’extravasation du radiotraceur.
4.6.2.3 Détection des modifications métaboliques précoces
4.6.2.3.1 Objectif :
Connaître la capacité de la scintigraphie au FDG pour évaluer des variations rapides de métabolisme tumoral comme le rejet de la greffe provoqué par l’arrêt des traitements immunosuppresseur.
4.6.2.3.2 Méthode :
Nous avons étudié le modèle de mélanome greffé sur un groupe de 3 rats Sprague-Dawley immunodéprimés par injection de Cyclosporine A de J0 le jour de la greffe à J7.
La progression de la maladie était estimée par :
- la mesure du volume tumoral et du poids des rats tous les jours
- et la réalisation hebdomadaire d’une tomoscintigraphie au FDG pendant 3 semaines soit à J5, J12, J15 et J28.
- Chaque acquisition scintigraphique était réalisée selon le protocole habituel:
- Mise à la diète alimentaire le matin du jour de la scintigraphie (soit 6h avant l’injection de 14h) mais boisson à volonté.
- Injection intraveineuse du radiotraceur 17,5 MBq (500µCi) de 18FDG (soit Flucis®, Cisbio international, Gif/Yvette) dans une veine caudale sous anesthésie générale par Isoflurane 4% et 02 à 5L/mn.
- Temps d’attente entre l’injection et le passage sous caméra de 4h30 à 5h.
- Passage sous la caméra sous anesthésie générale (Isoflurane et O2)
- Protection de la machine et du sol par des draps à usage unique en papier non tissé
- Protocole d’imagerie d’émission biphotonique:
- Rat en procubitus membres postérieurs vers la caméra
- Acquisition en matrice 128x128
- Spectrométrie 30 % centrée sur le pic photoélectrique à 511 keV et en mode de coïncidence Pic photoélectrique/Pic photoélectrique
- 30 projections de 40 secondes corrigées de la décroissance.
- Zoom de 2
- Réarrangement des données pendant l’acquisition
- Traitement des données
- Reconstruction par algorithme itératif EMML à 20 itérations
- Résultats sous formes de coupes de 2,2 mm d’épaisseur dans les 3 plans de l’espace (transverse, frontal et sagittal) et reconstruction en mode 3D tournant par technique MIP (maximum intensity projection).
- Quantification une ROI sur la tumeur et en comparant l’activité enregistrée dans la tumeur et sur le corps entier dans une coupe épaisse corps entier de 28,6 mm d’épaisseur et sans correction de décroissance compte tenu de l’utilisation d’un rapport de fixation tumorale sur fixation totale.
4.6.2.3.3 Résultats de la détection des modifications métaboliques précoces
| Rat NRR | jours | Poids ( gr) |
FDG (%) |
Volume mm3 |
| greffe | 1 | 55 | 0 | |
| 5 | 70 | 4 | 0 | |
| 6 | 72 | 0 | ||
| 7 | 74 | 7 | 23 | |
| 8 | 78 | 88 | ||
| 11 | 2 048 | |||
| Stop Cyclo | 12 | 96 | 18 | 3 240 |
| 13 | 4 000 | |||
| 14 | 104 | 4 400 | ||
| 15 | 109 | 7 | 3 240 | |
| 16 | 108 | 2 888 | ||
| 19 | 113 | 1 372 | ||
| 21 | 119 | 1 372 | ||
| 26 | 128 | 500 | ||
| 28 | 136 | 4 | 125 |
| Rat NVB | jours | Poids ( gr) |
FDG (%) |
Volume mm3 |
| greffe | 1 | 53 | 0 | |
| 5 | 57 | 1 | 0 | |
| 6 | 63 | 0 | ||
| 7 | 65 | 125 | ||
| 8 | 67 | 126 | ||
| 9 | 108 | |||
| 11 | 1 089 | |||
| Stop Cyclo | 12 | 86 | 10 | 1 372 |
| 13 | 96 | 1 568 | ||
| 14 | 96 | 1 568 | ||
| 15 | 100 | 4 | 1 437 | |
| 16 | 109 | 1 372 | ||
| 19 | 122 | 1 352 | ||
| 21 | 121 | 1 089 | ||
| 26 | 131 | 968 | ||
| 28 | 139 | 2 | 527 |
| Rat NBV | jours | Poids ( gr) |
FDG (%) |
Volume mm3 |
| greffe | 1 | 51 | 0 | |
| 5 | 53 | 1 | 0 | |
| 6 | 0 | |||
| 7 | 32 | |||
| 8 | 81 | 288 | ||
| 9 | 600 | |||
| Stop Cyclo | 12 | 100 | 33 | 4 200 |
| 13 | 102 | 5 954 | ||
| 14 | 114 | 8 640 | ||
| 15 | 115 | 22 | 8 928 | |
| 16 | 119 | 9 802 | ||
| 19 | 136 | 7 813 | ||
| 21 | 144 | 6 912 | ||
| 26 | 158 | 5 733 | ||
| 28 | 165 | 7 | 5 324 |
Figure 4-21 : Evolution de la fixation et du volume tumoral après l’arrêt de la cyclosporine A du rat NBV.
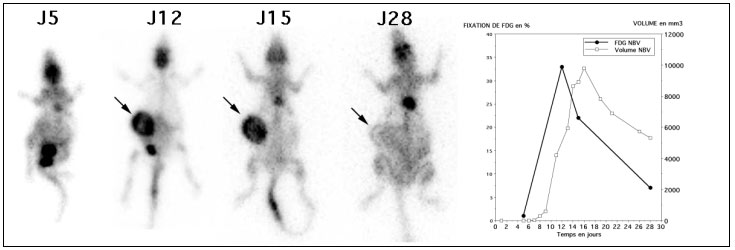
Figure 4-22 : Evolution de la fixation et du volume tumoral après l’arrêt de la cyclosporine A du rat NNR.
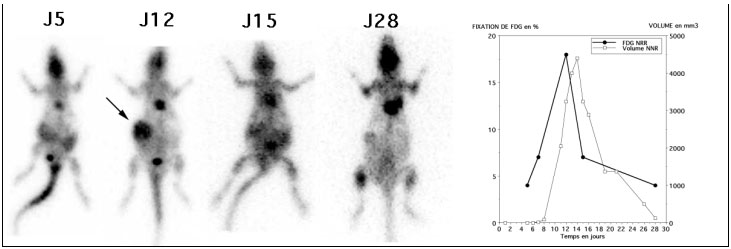
Figure 4-23 : Evolution de la fixation et du volume tumoral après l’arrêt de la cyclosporine A du rat NVB.
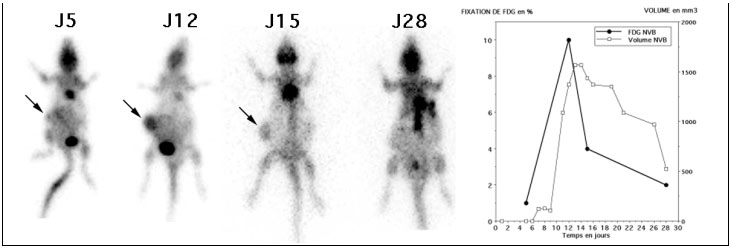
Les modifications métaboliques dans un modèle animal expérimental de rejet de greffe tumorale étaient détectées plus précocement par l’imagerie fonctionnelle au FDG que par les mesures de modifications morphologiques classiques.
Dans notre modèle de mélanome greffé sur rat Sprague-Dawley, l’immunosupression était obtenue par injection de cyclosporine. A l’arrêt de l’immunosuppression, le rejet de greffe est détecté plus précocement par la scintigraphie au FDG (Figures 4-21, 4-22 et 4-23). Après seulement 4 jours, les mélanomes fixaient de façon mois important le FDG que sur l’examen précédent. Pendant la même période, le volume des tumeurs était encore croissant et en moyenne pendant 3 jours supplémentaires. De plus 16 jours après l’arrêt de l’immunosuppression, des masses étaient encore palpables alors qu’aucune fixation significative de FDG n’était détectée.
Ces résultats soulignent l’intérêt de la scintigraphie au FDG pour détecter les modifications métaboliques précoces.
4.6.2.4 Comparaison : Tumeur vs Inflammation (1h/5h)
4.6.2.4.1 Objectif:
Evaluer la différence de dynamique de captation du FDG entre un foyer inflammatoire induit par injection de thérébentine et une tumeur greffée.
4.6.2.4.2 Méthode :
Sur 4 rats porteurs d’une greffe d’ostéosarcome de la patte postérieure droite, on provoquait un foyer aseptique par injection de 0,2 mL de thérébentine dans la cuisse contro-latérale (Kubota K 1995).
Une imagerie par scintigraphie au FDG était réalisée à 2 temps différents : précoce (1h) et tardif (5h) après injection IV du radiotraceur.
4.6.2.4.3 Résultats :
Du côté tumoral, la captation du FDG était plus intense sur les clichés tardifs (à 5h) par rapport aux clichés précoces (à 1h) (Figure 4-24-A). Du côté de l’abcès, la captation du FDG ne se modifiait pas avec le temps (Figure 4-24-B). Les acquisition en deux temps mettaient en évidence une différence significative de captation du FDG entre la tumeur et l’abcès (p = 0.04 avec le test non paramétrique de Mann & Whitney). Avec le temps la fixation tumorale augmentait alors qu’elle ne bougeait pas du côté de l’abcès.
Cette observation pourrait aider à préciser l’origine une formation inconnue en permettant de différencier l’origine tumorale de l’origine inflammatoire en réalisant des scintigraphies au FDG en deux temps.
| Rat | Rouge | Vert | Bleu | Noir |
| Poids (en grammes) | 188 | 185 | 172 | 152 |
| Délai depuis la greffe (en jours) | 42 | 42 | 42 | 42 |
| Volume tumoral en mm3 | 3 400 | 8 350 | 6 880 | 3 080 |
| Fixation de la tumeur à 1H | 10 % | 17 % | 22 % | 10 % |
| Fixation de la tumeur à 5H | 16 % | 22 % | 25 % | 16 % |
| Volume de l’abcès en mm3 | 1 350 | 970 | 3 180 | 1350 |
| Fixation de l’abcès à 1H | 6 % | 4 % | 6 % | 4 % |
| Fixation de l’abcès à 5H | 5 % | 4 % | 6% | 4 % |
Figure 4-24 : Différence de captation du FDG par la tumeur et l’abcès aseptique sur un même animal
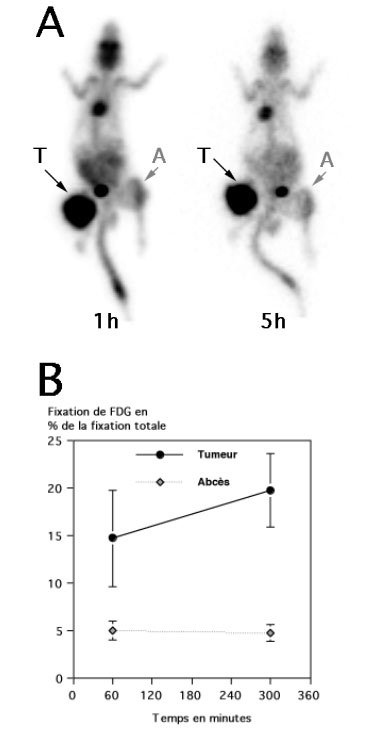
A : exemple d’acquisition à 1H et 5h post injection IV de FDG. La tumeur était une greffe d’ostéosarcome du côté droit( Flèche noire T) et l’abcès était provoqué par l’injection de thérébentine du côté gauche (Flèche grise A)
B : Evolution des captations du FDG par la tumeur et par l’abcès. Les résultats étaient donnés sous forme de moyenne et de leur écart type à 1 heure et 5 heures post-injection du FDG.
4.6.2.5 Détection des métastases
L’évolution de la maladie cancéreuse doit prendre en compte l’évolution de la tumeur primitive mais aussil’évolution métastatique. Un des rôles majeurs que l’on attend de la scintigraphie au FDG est de permettre un suivi des animaux plus proches des conditions cliniques avec en particulier la possibilité de détecter in vivo des atteintes métastatiques.
4.6.2.5.1 Objectif:
L’objectif principal était l’évaluation de la capacité de la scintigraphie au FDG pour détecter la présence de métastases. On se proposait de passer les mêmes animaux sur une machine TEP dédié à l’étude des petits animaux et sur notre machine TEDC. L’objectif secondaire était de comparer les résultats des deux dispositifs.
4.6.2.5.2 Méthode :
On utilisait le modèle de l’ostéosarcome greffé sur rat Sprague-Dawley immunocompétant dont on connaissait bien l’évolution sans traitement et le potentiel métastatique pulmonaire. En général, une période de 4 semaines après la greffe représentait le délai classique pour voir apparaître des métastases pulmonaires qui ne n’étaient détectables habituellement qu’après sacrifice de l’animal et analyse histologique des organes prélevés.
Les explorations scintigraphiques étaient programmées 4 semaines (J28) après la greffe d’ostéosarcome sur la cuisse droite de 2 rats Sprague-Dawley mâles.
La première acquisition scintigraphique était prévue sur une machine TEP animal dédiée à Paris dans le service de Biophysique de l’Hôpital Tenon du Pr. Talbot (Mosaic, Philips Medical System, USA) dont la résolution spatiale était de 2,14 mm.
- A J28 à Paris, l’imagerie TEP dédiée était débutée 1 h après l’injection IV de 100 MBq/kg (2,7 mCi/kg) de FDG (Flucis, CIS bio international, France) avec 3 positions de lit de 10 minutes. Une acquisition tardive était réalisée 3h après l’injection du radiotraceur et avec une seule position de lit de 20 minutes centrée sur le thorax.
- A J29 à Limoges, l’acquisition sur TEDC (Axis, Philips Medical System,USA) était réalisée 3h après injection IV de 370 MBq/kg (10 mCi/kg) de FDG (Flucis, CIS bio international, France) selon le protocole d’acquisition habituel .
- Les rats étaient sacrifiés a la fin de la scintigraphie sur TEDC à J29. Les poumons prélevés étaient examinés macroscopiquement et photographiés, avant d’être confiés au laboratoire d’anatomopathologie pour examen microscopique histologique.
4.6.2.5.3 Résultats
Un seul rat sur les deux animaux greffés avec un ostéosarcome dans la région para-tibiale, présentait des métastases pulmonaires 4 semaines après la greffe (Figure 4-25). La scintigraphie TEDC au FDG(A), en mode MIP, permettait de localiser in vivo une métastase pulmonaire (M1) qui était bien visible sur l’examen TEP dédié réalisé 1h post injection (B). Cette acquisition localisait de plus, une deuxième métastase inférieure (M2). L’examen TEP dédié tardif à 3h post injection (C) détectait une troisième métastase pulmonaire du côté droit (M3). La tumeur greffée (flèche T), le cœur (flèche C) et la vessie (flèche V) étaient repérés sur les deux scintigraphies TEDC et TEP dédié. L’autopsie des animaux (D) confirmait la présence de 3 métastases pulmonaires. Une métastase de 5 mm (M1) était localisée dans le poumon droit. La métastase de 4 mm (M2) de la partie inférieure du poumon gauche n’était pas détectée par la TEDC mais sur les deux acquisition du TEP dédié (M2 flèche grise). La métastase de 3mm de la partie antérieure de la base pulmonaire droite (M3 flèche grise) n’était détectée que sur l’acquisition tardive à 3h sur le TEP dédié animal.
Le deuxième animal ne présentait pas de métastases pulmonaire ni sur les acquisitions scintigraphiques ni sur le contrôle macroscopique et microscopique nécropsique. Les images respectives des deux caméras ne sont donc pas reproduites ici
Figure 4-25 :Détection scintigraphique au FDG de métastases pulmonaires par TEDC et TEP animal dédiée.
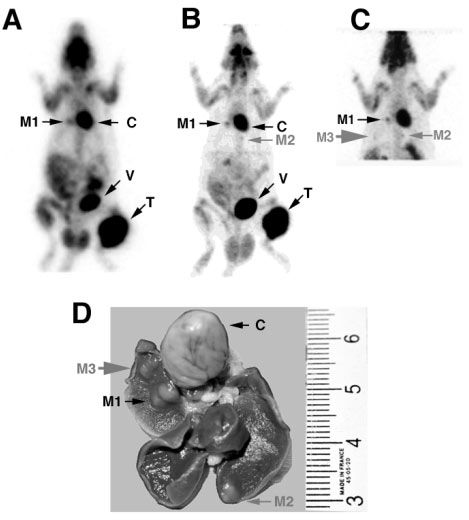
4.6.2.5.4 Comparaison TEDC/TEP animal
L’examen réalisé avec un TEP dédié animal permettait d’obtenir des images plus résolues de qualité supérieure dont l’impact était évident en particulier dans la détection des métastases pulmonaires. L’optimisation de l’imagerie dédiée était une démarche importante à mener puisque sur les images classiques à une heure post injection, 2 métastases sur trois étaient localisées alors que les 3 métastases étaient visibles sur l’acquisition tardive à 3h post injection. La différence qui existait entre l’imagerie dédiée et la caméra TEDC était inférieur à ce que l’on aurait pu attendre, en comparant les différences théoriques de résolution de 2,3 mm pour la première et 8 mm pour la seconde.
4.6.2.6 Suivi thérapeutique: ostéosarcome et endostatine intratumorale
4.6.2.6.1 Objectif
Concernant le suivi thérapeutique, nous avons voulu voir l’apport de l’imagerie au FDG dans un essai thérapeutique de thérapie génique sur le modèle d’ostéosarcome de rat.
4.6.2.6.2 Méthode
Sur deux groupes de 6 rats males Sprague-Dawley greffés avec de l’ostéosarcome le suivi clinique concernait la mesure du poids de l’animal et du volume de la tumeur deux fois par semaine. Le volume tumoral était calculé selon la formule de Carlson : V = 1/2 (ab2), où a est le plus grand diamètre et b le plus petit diamètre de la tumeur.
La fixation tumorale du FDG était estimée de façon hebdomadaire par le rapport de la fixation tumorale, dans une ROI dessinée sur la tumeur comparée à la fixation totale de l’animal comptée dans une coupe épaisse de 28,6 mm intéressant tout l’animal.
L’essai thérapeutique était basé sur l’expression d’un plasmide (pSecTag2, Invitrogen, San Diego) lié à un gène antiangiogénique (endostatine) introduit dans un vecteur liposomal provenant de la Société Biovector Therapeutics (Toulouse, France). Le Plasmide (120 mg) était mélangé avec 1.4 mg de liposomes pour être injecté en intra-tumoral une fois par semaine.
Le groupe traité de 6 animaux recevait le liposome contenant le plasmide avec le gène de l’endostatine. Le groupe témoin de 6 animaux recevait le liposome avec le plasmide sans le gène.
Cet essai thérapeutique était une expérience préliminaire, et l’essai thérapeutique antiangiogénique sur l’ostéosarcome du rat a été modifié avec un gain d’efficacité avec un nouveau type de liposome cationique injecté en intra-veineux (Dutour 2004).
4.6.2.6.3 Résultats: Corrélation entre la survie et la fixation de FDG
Pour évaluer l’apport de la scintigraphie au FDG dans le suivi thérapeutique, nous avons surveillé deux groupes de 6 rats greffés avec un ostéosarcome. Le groupe traité avec des liposomes contenant le gène de l’endostatine et le groupe témoin avec un liposome sans gène de l’endostatine étaient évalués pendant 3 semaines par mesure du volume tumoral et calcul de la fixation tumorale de FDG (Figure 4-26). Une semaine avant le début du traitement, il n’était pas mis en évidence de différence statistiquement significative du volume tumoral entre les deux groupes qui sont donc comparables.
Après la première injection soit après une semaine de traitement, la fixation tumorale de FDG et le volume tumoral étaient différents entre les 2 groupes (pfdg < 0.01 et pvol < 0.02 pour le test non paramétrique de Mann & Whitney). Cette différence persistait après un deuxième traitement (pfdg < 0.02 et pvol < 0.03). Après le troisième traitement et la mort de 3 rats témoins et d’un rat traité, la différence entre les deux groupes n’était significative que pour le volume tumoral (pfdg = 0.06 and pvol = 0.04).
Figure 4-26 : La mesure du volume tumoral et de la fixation de FDG dans un groupe traité et un groupe non traité de 6 rats greffés avec un ostéosarcome.
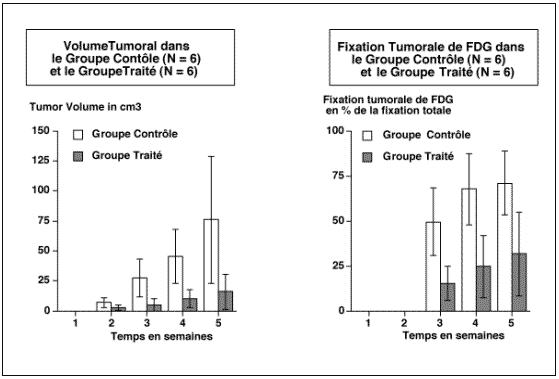
Figure 4-27 : Courbe de survie de deux groupes de rats avec un ostéosarcome - traités et non traités
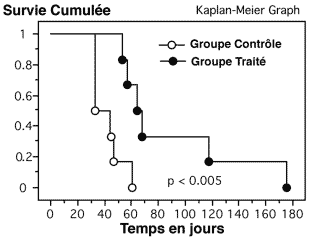
L’analyse des corrélations entre le poids, le volume tumoral, la fixation tumorale de FDG et la survie des animaux montrait que seule la fixation de FDG était corrélée (inversement) à la survie. L’évolution du poids et du volume tumoral n’étaient pas corrélés à la survie. La corrélation inverse entre la fixation de FDG et le délai de survie avait été trouvée significative dans le groupe traité (p = 0.002) et dans le groupe témoin non traité (p = 0.0003 par le test de régression multiple). Dans la courbe de survie selon Kaplan-Meier (Figure 4-17), il était noté une différence de survie significative entre les deux groupes. Le temps de survie de 50 % de l’effectif était de 33 jours pour le groupe contrôle non traité et de 64 jours pour le groupe traité (plog rank = 0.0046 pour la survie selon Kaplan-Meier).