CHAPITRE 1 : ETUDE BIBLIOGRAPHIQUE
Depuis les années 1950, de nombreux systèmes de protection contre l’oxydation des matériaux carbonés ont été étudiés. Dans un premier temps, nous traiterons les systèmes les plus simples, ne comportant qu’une seule couche pour aller, dans un second temps vers les systèmes actuels, plus complexes, pouvant contenir 3 à 4 couches.
1. LES SYSTEMES DE PROTECTION MONOCOUCHE
1.1 Les alliages de métaux nobles
Les alliages de métaux nobles ont d’abord été développés pour remplacer ceux à base de nickel utilisés pour des applications thermostructurales à des températures inférieures à 1373K. Des métaux du groupe du platine ont été choisis comme éléments de base, pour leur haute température de fusion et leur résistance à l’oxydation supérieure à celle des autres métaux réfractaires tels que Nb, Mo, Ta, Hf, W(77)... L’iridium a été retenu pour sa haute température de fusion (2683K), sa très faible perméabilité à l’oxygène (inférieure à la silice) et sa stabilité chimique vis à vis du carbone, en particulier sous forme de couche protectrice sur une structure en rhénium(61) Cependant, l’oxydation de l’iridium conduit à la formation d’espèces volatiles IrO2 et IrO3(19,35). L’incorporation d’aluminium (>55%mol) permet de former une couche d’alumine protectrice(19) mais aux dépens de la réfractarité car l’alliage Ir/55%mol Al est partiellement fondu à 1900K, par formation d’un eutectique. La résistance à l’oxydation de ces alliages binaires reste insuffisante à cause de la présence de domaines d’Ir et d’une oxydation interne. La stabilisation de la phase Ir/Al dans un plus large domaine de concentration en aluminium, par addition de cobalt, pourrait permettre d’améliorer la tenue à l’oxydation(19,35). De nombreux alliages à base d’iridium tels que Ir-Nb, Ir-Zr, Ir-Hf,... ont été élaborés(77), mais leur résistance à l’oxydation n’est pas encore connue. La principale limitation des alliages d’iridium reste le coût très élevé du métal et les difficultés d’approvisionnement car la production mondiale annuelle est d’environ 3,6 tonnes. Dans la même optique, les alliages dans les systèmes Zr-Pt(2), Hf-Ta(46) et Pt-Si(57) ont été étudiés mais les performances restent insuffisantes.
Les alliages de métaux nobles sont destinés à être utilisés dans les zones très sensibles. Leur coût et la nécessité d’employer des techniques de dépôt par voie sèche (CVD, projection plasma,...) rendent difficile l’élaboration de tels composés sur des pièces de grande taille et de forme complexe.
1.2 Les systèmes à base de bore
Les composés du bore sont incorporés dans les systèmes de protection du carbone car ils forment un verre susceptible de guérir les fissures et/ou de combler la porosité, constituant ainsi une barrière de diffusion à l’oxygène à basse température (873-1173K). Cependant, la température maximale d’utilisation de B2O3 est d’environ 1473K pendant quelques heures à cause de sa grande vitesse d’évaporation. Clougherty et al(20) ont montré qu’il existe une température à laquelle les vitesses de formation et d’évaporation de B2O3 sont égales. Cette température fixe la limite d’utilisation de la protection dans les conditions considérées. De plus, B2O3 n’est pas stable vis à vis du carbone. La réaction :
7 C + 2 B2O3→ B4C + 6 CO(g)
se produit dès 1600K, conduisant à une attaque du substrat. Une couche intermédiaire est donc nécessaire entre l’oxyde et le substrat.
B2O3 peut être apporté directement(64, 47, 45) ou être le produit de l’oxydation d’un des composés suivants, B4C(32, 33, 34, 60), BN(60, 28) ou de borures(20, 51). B4C et BN présentent les mêmes limitations que B2O3 pur car les produits de l’oxydation sont B2O3 et CO ou N2.
Les borures de métaux réfractaires MeBx sont une alternative intéressante si l’oxyde du métal peut donner un verre réfractaire avec B2O3. Cependant, l’espoir de former une couche d’oxyde MeOy dense et protectrice est illusoire car la volatilisation de B2O3 conduit toujours à une large porosité.
Les borures semblent être les précurseurs de B2O3 les plus intéressants mais ils ne peuvent pas être utilisés seuls. Les critères de sélection d’un borure sont sa stabilité chimique à haute température, sa température de début d’oxydation, la stabilité de l’oxyde du métal et sa capacité à former un verre.
La figure 1 présente les stabilités respectives des borures les plus réfractaires et de leurs oxydes.
Figure 1 : Variation de l’enthalpie libre standard des borures thermodynamiquement les plus stables à 2000K (a)
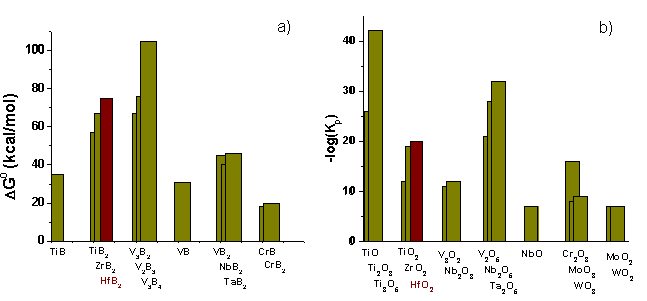
Constantes d’équilibre des oxydes thermodynamiquement les plus stables à 2000K (75) (b)
Ces graphiques montrent que HfB2 et HfO2 représentent un bon compromis en terme de stabilité. HfB2 s’oxyde dès 873K, assurant la formation de B2O3 protecteur mais à 1973K, la transition de phase monoclinique quadratique de HfO2 accélère fortement la cinétique d’oxydation(13, 14).
1.3 Les systèmes à base de silice
La silice est l’une des meilleures barrières de diffusion à l’oxygène(40, 50) (figure 2). Cependant, son instabilité sous faible pression partielle d’oxygène conduit à sa rapide volatilisation ce qui limite son utilisation à des températures inférieures à 1873K.
En outre, à basse température, la silice n’est pas suffisamment fluide pour « cicatriser » les défauts du revêtement. En général, les systèmes précurseurs de silice ne sont pas protecteurs en dessous de 1473K.
L’amélioration de son étanchéité à basse température peut être obtenue grâce au choix d’un matériau susceptible de combler les fissures dès 773K ou au blocage des sites de réaction du carbone par l’adsorption de borates ou de phosphates. Il s’agit, en général, d’introduire un composé formant un oxyde fluide à basse température ou d’élaborer une couche d’oxyde réfractaire dense (cordiérite, mullite, silicate de terres rares, verres réfractaires…), capable d’assurer la protection jusqu’à 1473K.
Figure 2 : Constantes de perméabilité à l’oxygène en fonction de la température de plusieurs matériaux
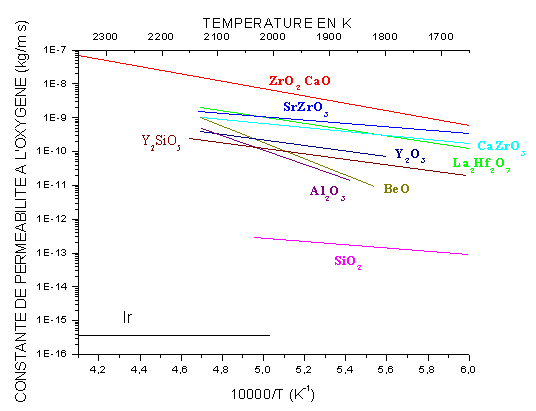
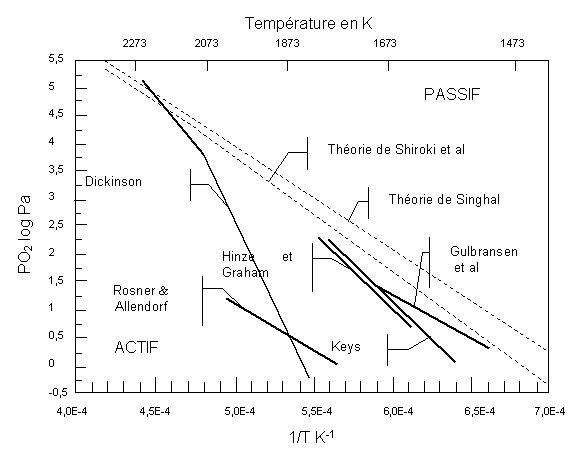
Figure 3 : Diagramme de transition de l’oxydation active/passive du SiC(64)
La silice est le plus souvent formée à partir d’un précurseur, soit par dégradation thermique, soit par oxydation. Les matériaux les plus étudiés sont les siloxanes, le nitrure et le carbure de silicium, les siliciures et le borure de silicium.
Le carbure de silicium et le nitrure de silicium sont les précurseurs de silice les plus utilisés pour protéger les matériaux carbonés car ils présentent une bonne compatibilité chimique avec ce type de substrats, un coefficient de dilatation thermique assez faible (3 à 4 10-6 K-1) et forment une couche de silice protectrice, dans leur domaine d’oxydation passive (figure 3). Cependant, leur fissuration rend inefficace la protection entre 773K et 1473K. Le problème de la fissuration des revêtements de SiC a été traité principalement de trois manières. D’une part, en diminuant le coefficient de dilatation thermique, soit dans l’ensemble du revêtement, soit graduellement de l’interface externe à l’interface interne(1, 62, 63). D’autre part, en diminuant l’épaisseur de la couche(4) ce qui implique l’élaboration d’un empilement de forte cohésion car chaque interface est une source potentielle de délaminage. Enfin, en comblant les fissures avec un composé réfractaire venant en complément du carbure de silicium déjà utilisé ou par addition d’autres produits réfractaires (siliciures, carbures, borures,…)(78, 39, 39) ou éléments d’alliage (C, N, B)(6, 15). Ces approches seront développées dans la section consacrée aux revêtements multicouches.
Les siliciures MoSi2, WSi2, Nb5Si3, MnSi2,... sont, a priori, également d’excellents candidats car ils sont couramment utilisés pour des applications nécessitant une bonne tenue à l’oxydation à haute température. Cependant, à basse température (<973K), ils subissent un phénomène de « peste » qui entraîne la désintégration du matériau. Dans le cas de MoSi2, cette oxydation catastrophique s’initie sur un défaut, un pore ou une fissure où la formation de silice et de MoO3 avec une augmentation de volume, entraîne l’écaillage du matériau(56, 44). De plus, MoO3 a une faible température de fusion (1073K), une bonne fluidité mais une forte pression de vapeur à haute température. La cinétique d’oxydation du MoSi2 dépend directement de la pression partielle d’oxygène. A haute température et pression partielle d’oxygène élevée (1693K et >104 Pa), il y a formation de silice vitreuse. L’oxydation est passive. A faible pression partielle d’oxygène, la silice se vaporise, c’est l’oxydation active. MoSi2 n’est donc pas un aussi bon cicatrisant qu’un verre borosilicaté et le problème de « peste » doit être résolu pour obtenir une bonne protection.
Dans ce même groupe de matériaux, ZrSi2(73, 36) présente une très bonne tenue à l’oxydation jusqu’à 1923K pendant plusieurs centaines d’heures grâce à la formation d’oxydes très stables. Cependant, ce système de protection n’est pas efficace à basse température en cas de fissuration du revêtement.
Parmi les borures, SiB6 a fait l’objet de peu d’études. Un revêtement élaboré sur du graphite est décrit dans un brevet déposé en 1966(21). Une bonne protection est obtenue à 1643K pendant 234000s. Ce type de système reste limité par la stabilité de la silice à haute température mais présente l’avantage de disposer d’une phase cicatrisante à basse température.
1.4 Les autres systèmes
Le carbure d’hafnium(7, 8, 29) a été introduit dans la composition des protections en vue de former du HfO2, un des oxydes les plus réfractaires (Tf=3053-3173K) et possédant une faible pression de vapeur à haute température. L’objectif est l’obtention d’une couche dense résultant de l’oxydation de HfC. Cependant, s’il est stable à très haute température, HfO2 subit une transition de phase à 1973K accompagnée d’une variation de volume de 3% et possède une forte perméabilité à l’oxygène. De plus, l’oxydation de HfC s’accompagne du départ de CO2 qui rend poreuse la couche de HfO2.
2. CRITERES DE SELECTION D’UNE BARRIERE DE DIFFUSION
2.1 Considérations générales
De nombreuses réflexions ont été menées sur le choix de la structure et des matériaux adaptés à la protection de matériaux carbonés(74, 22, 48). Les figure 4 et 5 montrent une synthèse des principales fonctions que le revêtement doit remplir pour constituer une bonne protection contre l’oxydation.
Figure 4 : Principales fonctions d’un système de protection
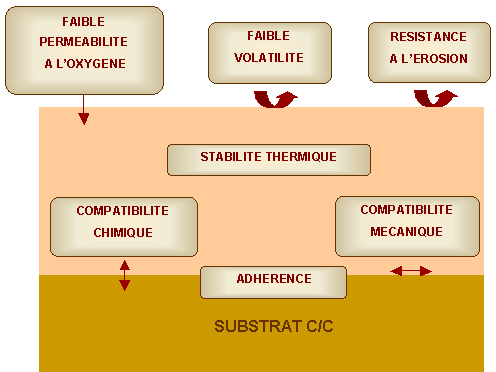
Figure 5 : Comportement à l’oxydation de composites C/C protégés
Le premier point est la bonne adhésion qui regroupe plusieurs exigences, la liaison forte entre le revêtement et le substrat et les compatibilités mécanique et chimique entre les matériaux utilisés. La liaison entre deux matériaux peut être d’origine mécanique, en raison de l’interpénétration des matériaux dans leurs porosités respectives ou chimique par réaction entre les matériaux pour former une troisième phase.
Les obstacles à une bonne adhésion sont, les contraintes thermiques qui peuvent se développer si les coefficients de dilatation thermique sont trop différents et les réactions chimiques parasites susceptibles de former une phase gazeuse. L’augmentation de pression peut alors conduire à l’écaillage du revêtement ou à la formation de bulles en présence d’une phase fluide.
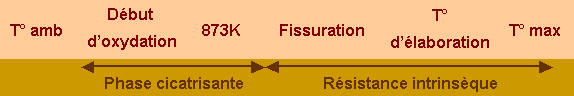
Le second point concerne le revêtement lui-même. Le système doit être stable jusqu’à la température maximale d’utilisation pour éviter les variations de composition ou les changements de structure. L’efficacité de la protection est en partie liée à la perméabilité à l’oxygène de ses constituants. Si l’élaboration d’un revêtement non fissuré est impossible, la présence d’une phase cicatrisante est nécessaire pour limiter l’accès de l’oxygène à basse température.
La durée de vie de la protection, pour une épaisseur donnée, dépend de sa vitesse de vaporisation. Dans le cas d’une utilisation sous flux de gaz supersonique, une bonne résistance à l’érosion est indispensable.
Compte tenu des problèmes posés, de nombreux paramètres doivent être pris en compte dans le choix du système de protection. Le revêtement doit remplir quatre grandes fonctions.
La première fonction est d’empêcher la réaction entre l’oxygène et le substrat en formant une barrière de diffusion, la perméabilité à l’oxygène est donc un paramètre essentiel. Deux critères sont à considérer, la perméabilité intrinsèque du système et la microstructure du revêtement. Les oxydes et en particulier la silice sont les meilleures barrières à la diffusion de l'oxygène (figure 2). De nombreux concepts de protection sont basés sur la formation d'une couche de silice. Cependant une faible perméabilité est inutile si le revêtement est fissuré. Les principales sources de fissuration sont les contraintes thermiques, l’anisotropie du matériau et les transformations de phases qui s’accompagnent de variations volumiques importantes. L’intensité des contraintes thermiques dépend de la différence de coefficient de dilatation thermique des matériaux et de leurs propriétés mécaniques. Un gradient de composition à l’interface permet une variation continue des propriétés physiques et la répartition des contraintes sur un volume de matériau plus grand. Les matériaux cristallins à haute symétrie résistent généralement mieux aux chocs thermiques. Par ailleurs, pour certains oxydes apparaît la possibilité de polymorphisme. Les transformations allotropiques de HfO2 et ZrO2 s’accompagnent d’une variation de volume de la maille élémentaire qui peut induire la formation de fissures.
La seconde fonction est de protéger le substrat dans une large gamme de température et de pression, typiquement de 673K à la température la plus élevée possible avec une possibilité de cyclage thermique. Les constituants du système doivent donc être stables thermiquement et chimiquement jusqu’à leur température de fusion. Les oxydes sont, en général, stables dans l’air et les atmosphères oxydantes mais la liaison oxyde/substrat nécessite des sous couches d'adaptation dont la température de fusion doit être au moins égale à celle de l’oxyde choisi. La gamme de température étendue et la difficulté d’élaborer un revêtement non fissuré nécessite de prévoir la formation d’une phase cicatrisante. Il s’agit en général d’un oxyde fluide, produit de l’oxydation d’un des constituants.
La troisième fonction est d’assurer une protection pendant la durée la plus longue possible compte tenu de la volatilisation et de l’érosion du revêtement. La vitesse de volatilisation est le facteur limitant d’un bon nombre de systèmes de protection, en particulier ceux efficaces à basse température car leur tension de vapeur est en général très élevée à haute température. La durée de vie du revêtement à la température maximale d’utilisation est directement liée à la réfractarité de la phase formée. Celle-ci doit également résister à l’érosion particulaire et à un flux de gaz supersonique.
La quatrième fonction est de limiter l’échauffement des pièces sous-jacentes. La chaleur accumulée en surface peut être dissipée par conduction thermique à travers le matériau et par rayonnement. La conductibilité thermique permet d’évacuer la quantité de chaleur transmise à travers une épaisseur donnée de matériau. Un compromis doit être trouvé entre la quantité de chaleur dissipée et la température atteinte par les structures sous-jacentes. Une bonne conductibilité est également un gage de bonne résistance aux chocs thermiques. L’émissivité d’un matériau caractérise la quantité d’énergie émise par rapport à un corps noir (émetteur idéal). L’émissivité, qui doit être élevée, dépend de sa nature physico-chimique et de son état de surface. Elle varie avec la longueur d’onde, la direction d’émission et la température de surface.
Plus généralement, il faut essayer de former une couche d'oxyde dense, continue et stable dans une large gamme de température. Les constituants doivent être inertes entre eux et stables jusqu’à la température d’utilisation. Comme aucun matériau n’est susceptible de remplir toutes ces fonctions, une structure multicouche doit être envisagée, au minimum trois couches semblent nécessaires :
- une couche externe de faible perméabilité à l’oxygène, stable thermiquement et résistante à l’érosion.
- une couche intermédiaire pour limiter la diffusion de l’oxygène et remplir les défauts (pores, fissures...) par formation d’une phase cicatrisante.
- une couche d’accrochage compatible chimiquement et mécaniquement avec le substrat.
2.2 La couche externe
La couche externe constitue la première barrière de diffusion à l’oxygène du revêtement et se trouve en contact direct avec l’atmosphère oxydante. Les propriétés du matériau recherché sont une faible perméabilité à l’oxygène, une grande stabilité thermique à très haute température, une structure dense et continue et une bonne résistance à l’érosion. Compte tenu de ces impératifs, le choix est vite restreint. Les deux familles de matériaux potentiels sont les métaux nobles et les oxydes réfractaires. L’étude bibliographique sur les monocouches montre que seuls les oxydes réfractaires semblent convenir. La couche externe pourra donc être élaborée sous la forme d’un oxyde solide (fritté) ou visqueux (vitrocéramique).
2.2.1 Oxyde solide
Parmi les oxydes les plus réfractaires, un compromis doit être trouvé entre perméabilité à l’oxygène et résistance à l’érosion. Al2O3 et Y2O3 ont des perméabilités très faibles mais une mauvaise résistance à l’érosion à l’opposé de HfO2, ZrO2 et ThO2. TiO2 peut également être intéressant mais sa cinétique d’oxydation dépend fortement de la pression partielle d’oxygène, ce qui peut entraîner une instabilité à haute température.
Les oxydes ont en général des coefficients de dilatation thermique élevés,
6-9.10-6 K-1 et les plus réfractaires sont particulièrement difficiles à fritter. De plus, HfO2 et ZrO2 subissent une transition de phase avec variation de volume. L’obtention d’une microstructure dense et non fissurée est donc
difficile en l’absence de composés stabilisants comme Al2O3, Y2O3 ou ZrO2.
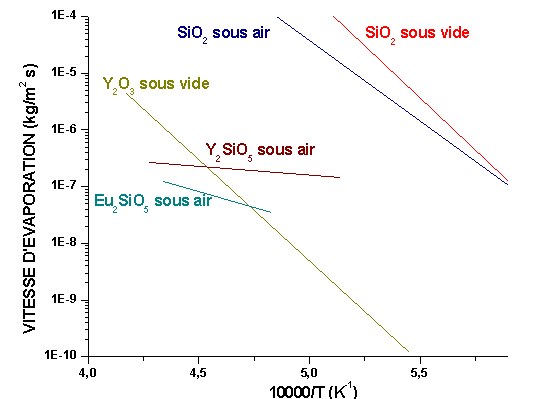
Les silicates de terres rares ont été étudiés par Ogura et al(52). Il ressort que Y2SiO5 présente un bon compromis entre vitesse de volatilisation (figure 6) et perméabilité à l’oxygène. Celle-ci est comparable à celle de Y2O3, ZrSiO4, Al2O3 et BeO entre 1427K et 1727K. Y2SiO5 est mécaniquement compatible avec SiC puisque leurs coefficients de dilatation thermique sont proches.
La mullite (3 Al2O3, 2 SiO2) cristallisée présente également une bonne tenue en atmosphère oxydante et sa stabilisation par l’yttrine permet d’améliorer les performances en présence d’humidité. Cependant, sa température de fusion d’environ 2000K ne permet pas une utilisation à très haute température.
2.2.2 Une vitrocéramique
Un oxyde visqueux présente l’avantage par rapport à un oxyde solide de former une couche continue et dense, ce qui élimine les problèmes de transition de phase. Cependant, la cristallisation du verre peut s’accompagner d’une variation de volume et la résistance à l’érosion est bien inférieure.
Les verres borosilicatés sont intéressants pour leur fluidité à basse température, qui permet de guérir les défauts du revêtement. Cependant, leur stabilité à haute température doit être améliorée. L’ajout d’oxydes tels que Al2O3, ZrO2, TiO2(31, 26) permet de diminuer la vitesse d’évaporation mais augmente la viscosité à basse température. Un compromis doit être trouvé entre viscosité et stabilité. Une autre solution consiste à élaborer un revêtement constitué de particules céramiques emprisonnées dans un verre. Guo et al(27) proposent de réaliser un gradient de composition, en augmentant la teneur en particules céramiques et en utilisant un verre de plus en plus réfractaire pour les couches les plus externes.
Figure 6 : Vitesses d’évaporation de plusieurs oxydes
Holcombe et al(31) ont élaboré et testé des mélanges d’oxydes réfractaires à faible coefficient de dilatation thermique. Il faut noter que les matériaux présentent une grande porosité, comprise entre 10 et 30% qui influe fortement sur les mesures, en particulier de coefficient de dilatation thermique.
Nous ne nous intéresserons qu’aux mélanges les plus réfractaires (température de fusion supérieure à 2073K) et stables à haute température.
Ces mélanges sont à base de HfO2, Ta2O5, TiO2, ZrO2, Al2O3, Nb2O5, Y2O3 et MgO. L’ajout de TiO2 permet de diminuer le coefficient de dilatation thermique au détriment de la température de fusion. Cependant, la comparaison directe des coefficients de dilatation thermique est difficile car la porosité des matériaux varie. En règle générale, les mélanges contenant HfO2 sont les plus réfractaires. Des coefficients de dilatation thermique compris entre 0 et 8,77.10-6 K-1 sont obtenus. Les études des propriétés des verres sont très rares au-dessus de 1873K.
2.3 La couche intermédiaire
La couche intermédiaire constitue la seconde barrière de diffusion à l’oxygène. Son rôle est primordial si la couche externe est fissurée ou vient à se fissurer pendant l’utilisation du matériau. Elle doit ralentir ou mieux, consommer l’oxygène qui migre vers le substrat par diffusion en phase solide à travers la couche externe ou par ses défauts. Cette couche doit être stable vis à vis de l’oxyde externe et ne pas subir de transition de phase pouvant conduire à des contraintes interfaciales. Sa résistance à l’oxydation doit être effective dès les basses températures, idéalement à partir de 773K, pour éviter l’oxydation du substrat si la couche externe ne peut pas être élaborée sans fissures. Le coefficient de dilatation thermique doit être intermédiaire entre celui de l’oxyde et celui de la couche d’accrochage, dans le cas d’une couche solide, pour limiter le développement de contraintes thermiques. Les produits d’oxydation sont préférentiellement solides ou fluides pour limiter le départ d’espèces volatiles pouvant conduire à la formation de bulles et à l’écaillage du revêtement.
Les matériaux susceptibles de posséder ces caractéristiques sont les carbures, les nitrures, les borures, les siliciures et les métaux nobles. Ces derniers ne seront pas traités compte tenu des limitations présentées précédemment. Le choix doit être fait en fonction de la stabilité intrinsèque des matériaux, de la température de début d’oxydation et de la nature des oxydes formés. On évitera les matériaux produisant des espèces volatiles, sauf s’il se forme une phase vitreuse susceptible de permettre leur élimination progressive.
Les carbures et nitrures produisent une espèce gazeuse lors de leur oxydation. L’oxydation de TiC entraîne en plus une augmentation de volume de 50%. L’oxyde s’écaille et se retrouve sous forme pulvérulente. Par contre, les carbonitrure d’hafnium et de zirconium forment une solution solide étendue avec l’oxygène. Il peut se former transitoirement une couche d’oxycarbonitrure MCxNyOz (avec M= Hf ou Zr) qui peut se substituer à la formation de l’oxyde et permettre de ne pas subir la transformation allotropique.
B4C est intéressant à basse température pour la formation B2O3 mais l’utilisation est limitée en température à cause du dégagement de COx et de la vaporisation de B2O3.
Les borures seuls ne sont pas adaptés pour une couche intermédiaire car B2O3 peut conduire à un écaillage à haute température et la couche résiduelle d’oxyde est poreuse. Le mélange borure/carbure ou nitrure de silicium est plus intéressant car de la silice protectrice est formée à haute température(20).
Comme nous l’avons dit dans le paragraphe 1.3, MoSi2 ne peut pas être utilisé seul à cause de son comportement à basse température(76). L’élaboration de composites avec des borures ou des carbures permet d’améliorer la résistance à l’oxydation(44, 56). ZrSi2 semble plus intéressant car il est stable vis à vis de SiC et forme ZrO2-SiO2. Cependant, l’absence de phase cicatrisante à basse température reste un problème. Les systèmes Hf-Zr/Si/C sont parmi les plus réfractaires. Les diagrammes de phases montrent que carbures et siliciures sont très stables(22).
2.4 La couche d’accrochage
La couche d’accrochage, en plus de son rôle de liaison chimique et/ou mécanique entre le revêtement et le substrat, et d’adaptation des différences de coefficient de dilatation thermique, doit constituer une barrière de diffusion au carbone pour éviter la réduction de la couche intermédiaire. L’élaboration d’une couche à gradient de composition permet de limiter les contraintes thermiques à l’interface avec le substrat(1, 40, 41, 42, 55).
Le matériau le plus utilisé est le carbure de silicium. Sa bonne résistance à l’oxydation et sa compatibilité chimique avec les matériaux carbonés permet son utilisation jusqu’à de très hautes températures. Des carbures tels que HfC, ZrC, TaC, WC, B4C, TiC (40, 41, 42, 3, 32, 33, 34, 60) mais aussi des nitrures comme Si3N4, BN(65, 66, 67, 68), et des siliciures comme HfSi2, ZrSi2(73, 36) sont utilisables. Les composés contenant du bore ne sont pas parfaitement adaptés car leur oxydation donne du B2O3, très volatil. La formation d’oxydes réfractaires à partir des carbures conduit à des couches très poreuses. Cependant, les données sur le comportement à l’oxydation des siliciures dans les conditions de rentrée atmosphérique sont limitées. Des systèmes binaires siliciure-carbure sont envisageables pour former des oxydes plus stables que la silice. Le mélange ZrSi2-SiC semble particulièrement intéressant car ZrSi2 est chimiquement compatible avec SiC et forme SiO2-ZrO2. Le zircon est favorable d’un point de vue dilatomètrique mais sa stabilité est mal connue(73).
3. LES BARRIERES MULTICOUCHES
Les stratégies adoptées pour les protections multicouches peuvent être classées en trois catégories, une couche d’accrochage renforcée par une phase cicatrisante, une couche d’accrochage doublée d’une barrière de diffusion renforcée par une phase cicatrisante et enfin une couche d’accrochage renforcée par une phase cicatrisante et une barrière de diffusion résistante à l’érosion.
3.1 Couche d’accrochage et phase cicatrisante
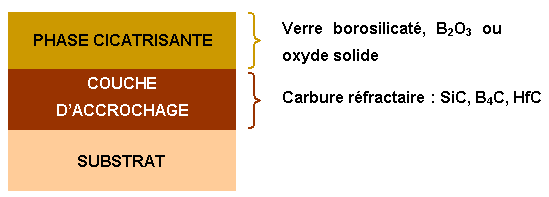
La couche d’accrochage est en général fissurée à cause des contraintes thermiques. Afin de limiter l’oxydation à basse température, une phase cicatrisante fluide est ajoutée pour combler les fissures avant utilisation. La silice seule ne permet pas de protéger efficacement le matériau à basse température (723K à 1073K) car sa viscosité est trop élevée. Le concept consiste à élargir la gamme de température de la protection (diminution de la viscosité de la silice à basse température) en appliquant une seconde couche cicatrisante ou en incorporant un précurseur adapté (figure 7).
Figure 7 : Schéma d’une protection couche d’accrochage/phase cicatrisante
Cependant, l’utilisation d’un verre borosilicaté(16, 37) ou de B2O3(49) en surface de la couche d’accrochage fait apparaître deux principales limitations :
- La vitesse de volatilisation de B2O3 au-dessus de 1273K
- La sensibilité à l’érosion gazeuse et particulaire
Lorsque la couche d’accrochage est constituée de MoSi2, son oxydation donne MoO3 qui a une faible viscosité à 1073K et de la silice(76). Mais MoO3 a une très forte tension de vapeur à haute température, ce qui limite son utilisation. L’incorporation de TiO2(26), utilisé pour limiter la volatilisation de B2O3, augmente la viscosité du verre le rendant moins efficace à basse température. Un compromis doit être trouvé entre vitesse de vaporisation et protection à basse température car l’augmentation de la réfractarité entraîne souvent l’augmentation de la viscosité à basse température.
Une phase fluide étant sensible à l’érosion, la réalisation d’une couche d’accrochage poreuse de B4C(32, 33, 34) permet de l’absorber dans sa porosité.
La phase cicatrisante peut être formée à partir de précurseurs qui donnent un verre fluide à basse température et qui devient plus réfractaire avec l’augmentation de la température et l’appauvrissement en B2O3(16)
Dans cette démarche, le principal problème est de stabiliser la phase vitreuse de manière continue dans toute la gamme de température pour ne pas conduire à une couche poreuse due à la volatilisation préférentielle d’un des constituants.
Une autre solution consiste à élaborer une couche de silicate dense. Ceux d’yttrium(71, 72, 5, 62, 63, 10, 11, 70) et de tungstène(18) donnent de bons résultats. Comme le montrent les figures 2 et 6, le silicate d’yttrium représente un bon compromis entre vitesse de volatilisation et perméabilité à l’oxygène. Cependant, la structure reste poreuse en l’absence de phase cicatrisante. Pour le silicate de tungstène, la diffusion de l’oxygène est élevée.
3.2 Couche d’accrochage, barrière de diffusion et phase cicatrisante
L’objectif recherché avec l’utilisation d’une barrière de diffusion à l’oxygène est d’augmenter la durée de vie de la protection (figure 8). Le matériau choisi pour cette nouvelle couche ou ses produits d’oxydation peuvent également entrer dans la composition de la phase cicatrisante pour stabiliser l’ensemble à haute température. Les limitations évoquées dans le paragraphe précédent sont donc toujours vraies.
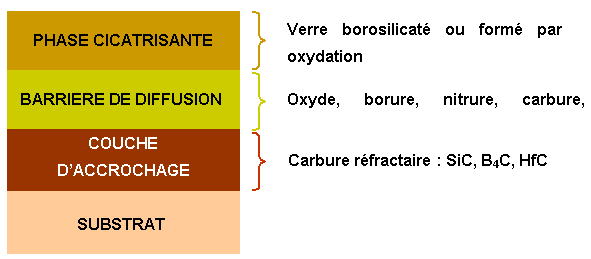
Figure 8 : Schéma d’une protection avec une couche d’accrochage, une barrière de diffusion et une phase cicatrisante
Un système de protection a été proposé, il est constitué de la séquence SiC/AlN/Al2O3(24). L’alumine est un matériau très intéressant pour sa faible perméabilité à l’oxygène. Cependant, une couche d’accrochage en carbure de silicium reste nécessaire. De plus, la présence de silice pendant l’oxydation permet de former de la mullite qui est très stable à haute température.
Des travaux dans le système Si-B-N-C ont également donné des résultats intéressants. Baldus et al(6) ont élaboré une couche de boro-carbo-nitrure de silicium par réaction en phase gazeuse entre un polysilazane et NH3. La céramique obtenue est amorphe jusqu’à 2173K et de stœchiométrie Si3BN3C. Les mesures des cinétiques d’oxydation montrent une vitesse plus lente que pour SiC et Si3N4, probablement à cause de la formation d’une barrière de diffusion à l’oxygène et de la conservation de la structure amorphe à haute température.
3.3 Couche d’accrochage, phase cicatrisante et barrière de diffusion et d’érosion
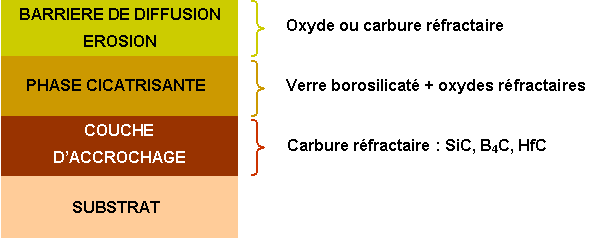
L’objectif est de diminuer la vitesse d’évaporation de la phase cicatrisante et de limiter son érosion. En général, le matériau choisi constitue également une bonne barrière de diffusion à l’oxygène (figure 9).
Figure 9 : Schéma d’une protection avec couche d’accrochage, phase cicatrisante et barrière de diffusion et de résistance à l’érosion
Bavarian et al(9) ont travaillé sur le système carbone/SiC/HfC-HfSi2/SiC élaboré par CVD. Ce concept comprend une barrière de diffusion en SiC et un "verre" protecteur à base de silicate d’hafnium qui se forme lors de l’oxydation de HfC et de HfSi2 (figure 10).
Figure 10 : Protection de composite carbone/carbone (9)
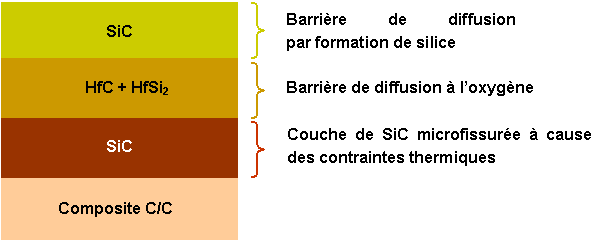
Les tests d'oxydation montrent deux comportements en fonction de la température. En dessous de 1873K, la couche externe de SiC s’oxyde pour former de la silice par diffusion aux joints de grains. Au-dessus de 1873K, la cinétique d’oxydation est linéaire à cause de l’évaporation de SiO2. Pour des durées plus longues elle devient parabolique car l’oxydation de HfC et HfSi2 forme une phase vitreuse protectrice, qui comble les fissures présentes dans la couche de SiC sous jacente. Les mécanismes qui contrôlent la cinétique sont la diffusion de l’oxygène vers le substrat et la diffusion des espèces carbonées vers l’extérieur. Pour des températures supérieures à 2200K l’évaporation de la silice et le départ des espèces carbonées entraîne la formation de bulles qui conduisent à une oxydation catastrophique du matériau.
De même, Buchanan et al(16, 17) ont choisi d’ajouter une couche de SiC déposée par CVD, contre l'érosion causée par un flux gazeux (O2, vapeur d’eau, N2...) et par des particules entraînées par les gaz. Les conditions opératoires de la CVD (faible pression et haute température) entraînent une perte de B2O3 en surface, une augmentation de la température de transition vitreuse du verre et un décalage du début de protection vers les températures plus élevées.
Le système SiC/B4C/SiC développé par Goujard et al(25) est basé sur la résistance à l’oxydation du SiC et la guérison des fissures développées lors de l’élaboration par CVD. B4C a un caractère protecteur de 723K à 1573K, température à laquelle SiC s’oxyde pour former de la silice. Les limitations de ce système sont liées à la stabilité de la silice.
Des revêtements plus complexes ont été étudiés, le système B,B4C+ZrO2 / B4C+SiO2+Li2ZrO3+SiC / B4C / SiC(12) comporte deux couches de cicatrisation, l’une pour les basses températures et la seconde pour les hautes températures. Le lithium est introduit pour limiter le départ de B2O3 en présence de vapeur d’eau. Li2ZrO3 est une source de zircone qui permet d’augmenter la viscosité et la réfractarité du verre formé.
3.4 Conclusions
Les performances en terme de température maximale et de durée d’utilisation sont prometteuses. Il semble qu’au moins trois couches soient nécessaires, une couche d’accrochage, une barrière de diffusion et une phase cicatrisante. Les obstacles viennent essentiellement du manque de données thermodynamiques nécessaires à la prédiction du comportement et des interactions à haute température de systèmes polyphasés (solide, liquide) et aux difficultés d’élaborer des revêtements sur des substrats de faible coefficient de dilatation thermique.
4. NOUVEAU CONCEPT DE PROTECTION PROPOSE : SiC/HfB2+SiC
4.1 Les conditions d’utilisation
Le besoin de protéger des matériaux carbonés contre l’oxydation existe pour de nombreuses applications, comme les échangeurs de chaleur dans l’industrie nucléaire, les moteurs d’avions ou de fusée et les véhicules spatiaux dans le domaine aéronautique.
Ces applications mettent en jeu des températures et des atmosphères très différentes pour des durées d’utilisation comprises entre quelques dizaines et quelques milliers d’heures. Par exemple, lors de la rentrée atmosphérique, la température maximale atteinte (typiquement 1873-1973K) dépend essentiellement de la trajectoire empruntée et de la forme de la pièce. La pression d’oxygène diminue dans les hautes couches de l’atmosphère et la gamme de pression partielle d’oxygène est de 103 à 2.104Pa. Dans le cadre du développement de futurs véhicules spatiaux réutilisables, ces cycles doivent être répétés et une durée de vie minimum de 180000 à 360000 s est recherchée. La rentrée atmosphérique entraîne des montées et descentes en température très rapides ce qui signifie que la résistance aux chocs thermiques de la protection est un facteur important. De plus, dans tous les cas, la protection devra être assurée depuis 773K, température de début d’oxydation du carbone, et la température de fonctionnement.
4.2 La couche d’accrochage en SiC
D’après l’étude bibliographique, l’utilisation de carbures ultra réfractaires n’a pas permis d’améliorer notablement les propriétés des revêtements. Nous conserverons donc une couche de carbure de silicium comme couche de compatibilité mécanique et chimique, son coefficient de dilatation thermique est l’un des plus faibles.
L’accrochage du revêtement peut avoir deux origines, la réaction chimique qui forme une phase de liaison et l’interpénétration des matériaux par le jeu de la porosité et de la rugosité du substrat.
Il semble que de bons résultats aient été obtenus avec des revêtements à gradient de composition(1, 40, 55). Une siliciuration par voie liquide permet de conjuguer tous ces avantages. La réaction chimique entre le substrat et le silicium liquide forme du SiC in situ. De plus, le silicium pénètre dans la porosité du substrat pour réagir, apportant un accrochage mécanique supplémentaire.
La couche d’accrochage n’a pas vocation à avoir la meilleure résistance à l’oxydation possible. Les limitations du carbure de silicium ont été discutées précédemment mais ne constituent pas un critère d’élimination.
4.3 La couche fonctionnelle de HfB2-SiC
4.3.1 Caractéristiques physico-chimiques du HfB2
La stabilité des matériaux réfractaires a été étudiée par Wiedemeier et al(75) sur la base des constantes d’équilibre et de l’enthalpie libre de formation. Les oxydes sont les plus stables suivis des borures, des carbures et des nitrures. Les oxydes ont des coefficients de dilatation supérieurs aux borures, ce qui est moins favorable en terme d’adaptation mécanique. Un compromis doit être trouvé entre la stabilité de l’oxyde et celle du borure et les propriétés mécaniques du borure.
Clougherty et al20) ont étudié les borures réfractaires dans l’objectif d’élaborer des matériaux résistants à l’oxydation à très haute température. HfB2 a été sélectionné parmi les borures réfractaires, car il présente le meilleur compromis entre propriétés mécaniques et résistance à l’oxydation. De plus, HfB2 possède le coefficient de dilatation thermique le plus faible des borures, quelle que soit sa structure, α est compris entre 5,3 10-6 K-1 et 7,69.10-6 K-1 en fonction du taux de densification, pour des échantillons obtenus sous forte pression et haute température. Il est chimiquement compatible avec SiC. Sa dureté à haute température lui confère une bonne résistance à l’érosion(20).
Ses deux principaux inconvénients sont sa forte densité qui diminue le rapport masse/performance et son coût élevé. Une utilisation sous forme de revêtement peut permettre de profiter des qualités thermochimiques de HfB2 en limitant l’impact sur le rapport masse/performances.
Les recherches sur la cinétique d’oxydation de HfB2 sont peu nombreuses, probablement en raison des difficultés pour élaborer des échantillons denses. Clougherty et al(20) ont étudié l’oxydation des borures réfractaires. Pour HfB2, la cinétique d’oxydation est parabolique. La vitesse de vaporisation de B2O3 est supposée constante et indépendante du temps, tant qu’il reste du B2O3 liquide. Si l’oxyde métallique croit paraboliquement, alors il existe un temps t0 après lequel la vitesse de vaporisation de B2O3 égale sa vitesse de formation. Au-dessus de 1488K, HfB2 s’oxyde en formant HfO2 et B2O3(g). Si la pression partielle de B2O3 à l’interface entre l’oxyde et le métal dépasse 105 Pa, la couche protectrice d’oxyde peut être détruite. A partir des enthalpies libres de formation des borures, Clougherty et al(20) ont calculé la pression de B2O3 à l’interface borure/oxyde. Elle est la plus faible pour HfB2, ce qui permet d’expliquer sa meilleure résistance à l’oxydation. Une tenue à l’oxydation supérieure a également été mise en évidence pour les matériaux sur stœchiométriques en métal.
Cependant, la transition de phase de HfO2 à 1973K entraîne une augmentation rapide de la vitesse d’oxydation(13, 14).
4.3.2 Les interactions entre HfB2 et SiC
Il a été montré que l’ajout d’une seconde phase permet d’améliorer la résistance à l’oxydation de ZrB2(58, 59) et de HfB2(23). L’ajout doit être chimiquement stable vis à vis du borure et des autres couches, jusqu’à la température maximale d’utilisation.
L’objectif de la seconde phase peut être double. D’une part augmenter la résistance à l’oxydation et d’autre part améliorer les propriétés mécaniques du revêtement, pour éviter qu’il ne se fissure. De nombreux additifs ont été testés, sous forme de fibres courtes ou longues, mais les difficultés d’élaboration ont conduit à choisir des particules, plus adaptées à l’application d’une pression.
La nature des ajouts étudiés est très variée, des métaux, des carbures, des nitrures et des siliciures. Il semble que le carbure de silicium apporte les plus grandes améliorations sur la résistance à l’oxydation de HfB2(20).
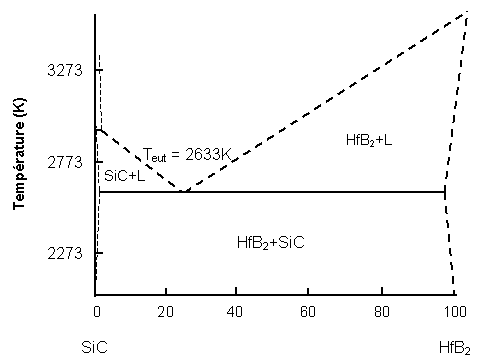
Les composites HfB2-SiC ont été étudiés sous forme de massifs élaborés par frittage sous charge(20, 30). Les analyses de microstructure montrent que ces constituants sont compatibles l’un par rapport à l’autre jusqu’environ 2573K (figure 11).
L’étude de la résistance à l’oxydation de ces composites à teneur variable en SiC a été entreprise. HfB2 s’oxyde préférentiellement à partir de 873K pour former une phase protectrice de B2O3. Cependant, la rapide volatilisation de B2O3 à partir de 1273K entraîne la formation d’une couche poreuse de HfO2. A partir de 1473K, le carbure de silicium s’oxyde à son tour. La structure finale d’un échantillon oxydé à haute température est formée d’une couche poreuse de HfO2 ou de HfSiO4 surmontée d’une couche de silice compacte. Clougherty et al(20) ont obtenu les meilleurs résultats avec des mélanges contenant entre 70 et 80%vol de HfB2.
Figure 11 : Diagramme de phase du système HfB2-SiC(53)
4.3.3. Etude thermodynamique du système Zr-B-Si-C-O
Le système Zr-B-Si-C-O a fait l’objet d’une étude thermodynamique pour tenter de prédire son évolution en atmosphère oxydante(69) jusqu’à 2273K. Les propriétés très proches de Zr et Hf permettent de supposer que de grandes similitudes existent entre ces deux systèmes. Cependant, le modèle utilisé ne prend pas en compte la formation de B2O3 et surtout des phases liquides de type silicate. L’étude thermodynamique débute à 1573K, température à laquelle tout le B2O3 s’est volatilisé, comportement qui a été observé lors de l’oxydation de massifs ZrB2-SiC(58, 59) et HfB2-SiC(30), matériaux à gros grains pour lesquels l’oxydation de chaque constituant est bien différenciée.
La zone affectée par l’oxydation a deux structures en fonction de la gamme de température considérée. Entre 1573 et 1773K, la séquence de la couche externe du matériau est, en partant de l’extérieur : SiO2 / ZrSiO4+SiO2 / ZrSiO4+ZrO2 / ZrO2+SiC / ZrB2+SiC. Alors qu’entre 1973 et 2273K, on observe la succession suivante : SiO2 / ZrO2+SiO2 / ZrO2+SiC / ZrB2+SiC.
Le modèle est en accord avec l’expérimentation car au-dessus de 1973K, le zircon se décompose en SiO2+ZrO2.
5. CONCLUSIONS
L’étude bibliographique a mis en évidence la nécessité d’un revêtement multicouche afin de remplir les fonctions nécessaires à la protection de matériaux carbonés dans une large gamme de température, de 773K à 1873-1973K, et de pression partielle d’oxygène, de 103 à 2.104 Pa pour une durée de plusieurs heures.
De nombreux paramètres ont été pris en compte dans le choix du système de protection, parmi lesquels, la stabilité thermique des constituants jusqu’à la température maximale d’utilisation, la compatibilité chimique et mécanique avec le substrat et la stabilité des phases formées lors de l’oxydation.
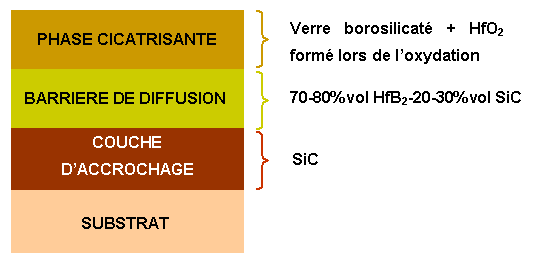
Le revêtement que nous proposons d’élaborer aura la structure suivante :
Figure 12 : Système de protection proposé
REFERENCES BIBLIOGRAPHIQUES
- AKIHIRO K., 1994, Production of high-temperature oxidation resistant C/C composite material, JP6345571, patent
- ALVEY M. D. and GEORGE P. M., ZrPt3 as a high-temperature, reflective, oxidation-resistant coating for carbon-carbon composites., Carbon, 29, 4/5, 1991, 523-530.
- ANDRYUSHIN S. G. and KASATKIN A. V., Refractory coatings of C-Me-Si and C-Me-B-Si systems for protection of carbon materials., J. of Phys., IV, 1995, C5-815 - C5-822.
- AOKI T., HATTA H., HITOMI T., FUKUDA H. and SHIOTA I., SiC/C multi-layered coating contribution to the antioxidation of C/C composites and the suppression of through-thickness cracks in the layer., Carbon, 39, 2001, 1477-1483.
- APARICIO M. and DURAN A., Yttrium silicate coatings for oxidation protection of carbon-silicon carbide composites., J. Am. Ceram. Soc., 83, 6, 2000, 1351-55.
- BALDUS H. P., PASSING G. and THIERAUF A.). Si-B(N,C) a new ceramic material for high performance applications. High temperature. Ceramic-matrix composite II: manufacturing and materials development, A. G. EVANS and R. NASLAIN, 58, 1995, 75-84.
- BARGERON C. B. and BENSON R. C., X-ray microanalysis of hafnium carbide film oxidised at high temperature., Surf. and Coat. Tech., 36, 1988, 111-115.
- BARGERON C. B., BENSON R. C., NEWMAN R. W. and JETTE A. N., Oxidation mechanisms of hafnium carbide and hafnium diboride in the temperture range 1400 to 2100°C., Johns Hopkins APL technical digest, 14, 1, 1993, 29-35.
- BAVARIAN, B., ARRIETA V., Coatings to provide high temperature oxidation protection for carbon carbon composites. the NACE Annual conference and corrosion show. Ed. NACE. 1993.
- BELOV A. N. and SEMENOV G. A., Calculation of thermodynamic properties of binary ZrO2(HfO2)-rare earth element oxide solid solutions from the volatility of the individual oxides., Russ. J. of Phys. Chem., 59, 9, 1985, 1390-1392.
- BELOV A. N. and SEMENOV G. A., Thermodynamics of binary solid solutions of zirconium, hafnium and yttrium oxides from high temperature mass spectrometry data., Russ. J. of Phys. Chem., 59, 3, 1985, 342-344.
- BENTSON, L. D., R. J. PRICE, et al., 1989, US5298311
- BERKOWITZ-MATTUCK J. B., High temperature oxidation. III Zirconium and Hafnium diborides., J. Electrochem Soc., 1966, 908-914.
- BERKOWITZ-MATTUCK J. B., High temperature oxidation. IV Zirconium and Hafnium carbides., J. Electrochem. Soc., 1966, 1030-1033.
- BILL J. and HEIMANN D., Polymer-derived ceramic coatings on C/C-SiC composites., J. Eur. Ceram. Soc., 16, 1996, 1115-1120.
- BUCHANAN F. J. and LITTLE J. A., Glass sealant for carbon/carbon composites., J. Mat. Sci., 28, 1993, 2324-2330.
- BUCHANAN F. J. and LITTLE J. A., The influence of chemical vapour deposition conditions on the structural stability and cracking of silicon carbide coatings on carbon-carbon composites., Surf. Coat. Tech., 53, 1992, 137-146.
- CHENG L., XU Y., ZHANG L. and GAO R., Oxidation behavior of C-SiC composites with a Si-W coating from room temperature to 1773K., Carbon, 38, 2000, 2133-2138.
- CLIFT W. M., McCARTY K. F. and BOEHME D. R., Deposition and analysis of Ir-Al coatings for oxidation protection of carbon materials at high temperature., Surf. and Coat. Tech., 42, 1990, 29-40.
- CLOUGHERTY E., KALISH D. and PETERS E., Research and development of refractory oxidation resistant diborides., Technical report AFML-TR-68-190, 1968.
- COLTON, 1966, US3275467, patent
- DERRE A., DUCARROIR M. and TEYSSANDIER F., Réflexions sur les possibilités d'amélioration de la résistance à l'oxydation des matériaux carbonés., Rev. Int. Hautes Temp. et Réf., 29, 1994, 11-35.
- FENTER J. R., Refractory diborides as engineering materials., communication privée.
- FRANC, O. and J. L. MACRET. Proceeding of ESA symposium, ESTEC, Noordwijk.1990
- GOUJARD S. and VANDENBULCKE L., Oxidation tests of carbonaceous composite materials protected by Si-B-C CVD coatings., Thin Solid films, 245, 1994, 86-97.
- GRAY P., 1990, Oxidation resistant refractory coated carbon-carbon composites, US4894286, patent
- GUO M., SHEN K. and ZHENG Y., Multilayered coatings for protecting carbon-carbon composites from oxidation., Carbon, 33, 4, 1995, 449-453.
- HANNACHE H., QUENISSET J. M. and NASLAIN R., Composite materials made from a porous 2D-carbon-carbon preform densified with boron nitride by chemical vapour inifiltration., J. Mat. Sci., 19, 1984, 202-212.
- HERTZ D., SPITZ J. and BESSON J., Elaboration du carbure de hafnium par dépôt chimique en phase vapeur., High temp.-high press., 6, 1974, 423-433.
- HINZE J. W. and TRIPP W. C. ,The high temperature oxidation behavior of a HfB2+20v/o SiC composite., J. Electrochem Soc., 122, 9, 1975, 1249-1254.
- HOLCOMBE C. E., MORROW M. K., SMITH D. D. and CARPENTER D. A. 1974. Survey study of low expanding high melting mixed oxides.
- HOLTZ R., TILLEY B., BENANDER R., MAGNOTTA V. and DYER P., 1994, Oxidation resistant carbon and method for making same, US5368938, patent
- HOLZL R., MAGNOTTA V., DYER P. and WITHERS JR H., 1994, Oxidation resistant carbon and method for making same, 5,286,565, patent
- HOLZL R., TILLEY B., BENANDER R., MAGNOTTA V. and DYER P., 1987, Oxidation resistant carbon and method for making same, 2,266,098, patent.
- HOSODA H., MIYASAKI S. and HANADA S., Potential of IrAl based alloys as ultrahigh-temperature smart coatings., Intermet., 8, 2000, 1081-1090.
- HSU S. E., WU H. D., WU T. M., CHOU S. T., WANG K. L. and CHEN C. I. Oxidation protection for 3D carbon/carbon composites. 43th congress of the international astronautical federation, Washington DC. 1992
- ISOLA C., APPENDINO P., BOSCO F., FERRARIS M. and SALVO M., Protective glass coating for carbon-carbon composites., Carbon, 36, 7-8, 1998, 1213-1218.
- JOSHI A. and LEE J. S. Coatings with particulate dispersions for high temperature oxidation protection of carbon and C/C composites. Composites Part A. E. S. Limited, 1997, 181-189.
- JOSHI A. and LEE J. S. Microstructure and properties of protective coatings on carbon processed by fused slurry method. 39th International SAMPE symposium, april 11-14, 1994, 2948-2955.
- KAWAI C. and IGARASHI T., 1991, Carbon fiber-reinforced composite material, EP0435039, patent
- KAWAI C. and IGARASHI T., 1992, Carbon fiber-reinforced composite material having a gradient carbide coating, JP5254397, patent
- KAWAI C., 1991, Coated carbon fiber reinforced composite material, JP3153584, patent
- KNIGHTS C. F., Coatings for composites- a theoretical assessment., Inst. Phys. Conf. Ser., III, 1990, 163-172.
- LEE E. W., KHAN A., MAHAPATRA R. and WALDMAN J. The oxidation resistance of MoSi2 composites. JOM, 43, 3, 1991, 54-57.
- LOBIONDO N. E., JONES L. E. and CLARE A. G. Halogenated glass systems for the protection of structural carbon-carbon composites., Carbon, 33, 4, 1995, 499-508.
- MARNOCH K. High-temperature oxidation resistant hafnium tantalum alloys., J. of Met., 1965, 1225-1231.
- McKEE D. W. ,Oxidation behavior of matrix-inhibited carbon-carbon composites., Carbon, 26, 5, 1988, 659-665.
- McKEE D. W. ,Oxidation protection of carbon materials., Chem. and Phys. of Carbon, 23, 1991, 173-232.
- McKEE D. W., SPIRO C. L. and LAMBY E. J. ,The effects of boron additives on the oxidation behavior of carbons., Carbon, 22, 6, 1984, 507-511.
- MEEK R. ,Diffusion coefficient for oxygen in vitreous SiO2., J. Am. Ceram. Soc., 56, 6, 1973, 341-342.
- MIKIO S. and HIROHIDE I., 1996, Carbonaceous member and method for coating surface, JP8217575, patent
- OGURA Y., KONDO M. and MORIMOTO T. Y2SiO5 as oxidation resistant coating for C/C composites. ICCM-10, Canada. 1995
- ORDAN'YAN S. S., DMITRIEV A. I., VIKHMAN S. V. and CHESTNOKOVA M. P., Interaction in the SiC-HfB2 system., Russ. J. of Appl. Chem., 66, 5, 1993, 936-937.
- SOGABE T., OKADA O., KURODA K. and INAGAKI M., Improvement in properties and air oxidation resistance of carbon materials by boron oxide impregnation., Carbon, 35, 1, 1997, 67-72.
- SOHDA Y., KUDE Y., UEMURA S., SAITOH T., WAKAMATSU Y. and NIINO M.. Carbon/carbon composites coated with SiC/C functionnally gradient materials. Ceram. Trans. Functionnally gradient materials. J.BIRCH, M.KOIZUMI, T.HIRAI and Z. A. MUNIR. 34: 125-132. 1993
- THOM A. J., SUMMERS E. and AKINC M., Oxidation behavior of extruded Mo5Si3Bx-MoSi2-MoB intermetallics from 600°C-1600°C., Intermet., 10, 2002, 555-570.
- TOMIZAWA Y., 1993, Anti-oxidative coating of carbonaceous matrix, JP5117066, patent
- TRIPP W. C. ,Thermogravimetric study of the oxidation of ZrB2 in temperature range of 800° to 1500°C., J. Electrochem. Soc., 118, 7, 1971, 1195-1199.
- TRIPP W. C., DAVIS H. H. and GRAHAM H. C.,“Effect of an SiC addition on the oxidation of ZrB2., Ceram. Bull., 52, 1973, 612-616.
- TSOU H. T. and KOWBEL W., A multilayer plasma-assisted CVD coating for oxidation protection of carbon-carbon composites., J. Adv. Mat., avril 1996, 1996, 9-13.
- TUFFIAS R. H., Fabrication processes for Irridium/Rhenium combustion chambers., Mat. Manuf. Process., 13, 5, 1998, 773-782.
- ULLMANN T., HALD H., VOLLRATH O., GROTHEER H.-H., HAIDN O. and AUWETER-KURTZ M.. Behaviour of C/C-SiC material in reentry and H2/O2 combustion environment. 3rd European workshop on thermal protection systems, Noordwijk, The Netherlands.1998
- ULLMANN T., SCHMUCKER M., HALD H., HENNE R. and SCHNEIDER H.. Yttrium-silicates for oxidation protection of C/C-SiC composites, Munich. 2001
- VAUGHN W. L., Active-to-passive transition in the oxidation of silicon carbide and silicon nitride in air., J. Am. Ceram. Soc., 73, 6, 1990, 1540-1543.
- VELTRI R. and GALASSO F., 1984, Composite silicon carbide coatings for carbon carbon materials, US4476178, patent
- VELTRI R. and GALASSO F., 1984, Composite silicon carbide/silicon nitride coatings for carbon-carbon materials, US4472476, patent
- VELTRI R. and GALASSO F., 1986, Composite SiC/Si3N4 coatings on carbon-carbon composites materials, FR2567120, patent
- VELTRI R. D. and GALASSO F. S., 1986, Composite SiC/Si3N4 coating for carbon-carbon materials, GB2161151, patent
- WANG C. R., YANG J.-M. and HOFFMAN W., Thermal stability of refractory carbide/boride composites., Mat. Chem. and Phys., 74, 2002, 272-281.
- WEBSTER J. D., HAYES F. H. and TAYLOR R., Thermodynamic modelling and experimental studies in the design of integrated oxidation protection systems for ceramic matrix composites., Key Eng. Mat., 127-131, 1997, 1225-1232.
- WEBSTER J. D., WESTWOOD M. E., HAYES F. H., DAY R. J., TAYLOR R., DURAN A., APARICIO M., REBSTOCK K. and VOGEL W. D., Oxidation protection coatings for C/SiC based on Y2SiO5., Key Eng. Mat., 132-136, 1997, 1641-1644.
- WEBSTER J. D., WESTWOOD M. E., HAYES F. H., DAY R. J., TAYLOR R., DURAN A., APARICIO M., REBSTOCK K. and VOGEL W. D., Oxidation protection coatings for C/SiC based on Yttrium silicate., J. Eur. Ceram. Soc., 18, 1998, 2345-2350.
- WEI W. C. and WU T. M., Oxidation of carbon/carbon composite coated with SiC-(Si/ZrSi2)-ZrSi2., Carbon, 32, 4, 1994, 605-613.
- WESTWOOD M. E., WEBSTER J. D., DAY R. J., HAYES F. H. and TAYLOR R., Oxidation protection for carbon fibre composites., J. Mat. Sci., 31, 1996, 1389-1397.
- WIEDEMEIER H. and SINGH M., Thermal stability of refractory materials for high-temperature composite applications., J. Mat. Sci., 26, 1991, 2421-2430.
- XU Y., CHENG L., ZHANG L. and YING H., Oxidation behavior and mechanical properties of C/SiC composites with Si-MoSi2 oxidation protection coating., J. Mat. Sci., 34, 1999, 6009-6014.
- YAMABE-MITARAI Y., MARUKO Y. and HARADA H., Ir-base refractory superalloys for ultra high temperatures., Metal. and Mat. Trans., 29A, 1998, 537-549.
- ZHU Y.-C., OHTANI S., SATO Y. and IWAMOTO N., Formation of functionnally gradient (Si3N4+SiC)/C layer for the oxidation protection of carbon-carbon composites., Carbon, 37, 1999, 1417-1423.